Versión 1.
https://canal.uned.es/mmobj/iframe/id/25399
Si dispones del manual en papel y te apetece, puedes ayudar a mejorar la calidad compartiendo una foto de las figuras con mejor calidad y lo cambiamos. .
El espectro bipolar no es. materia de examen pero el ED recomienda su lectura completa (esto solo es un resumen).
El espectro bipolar
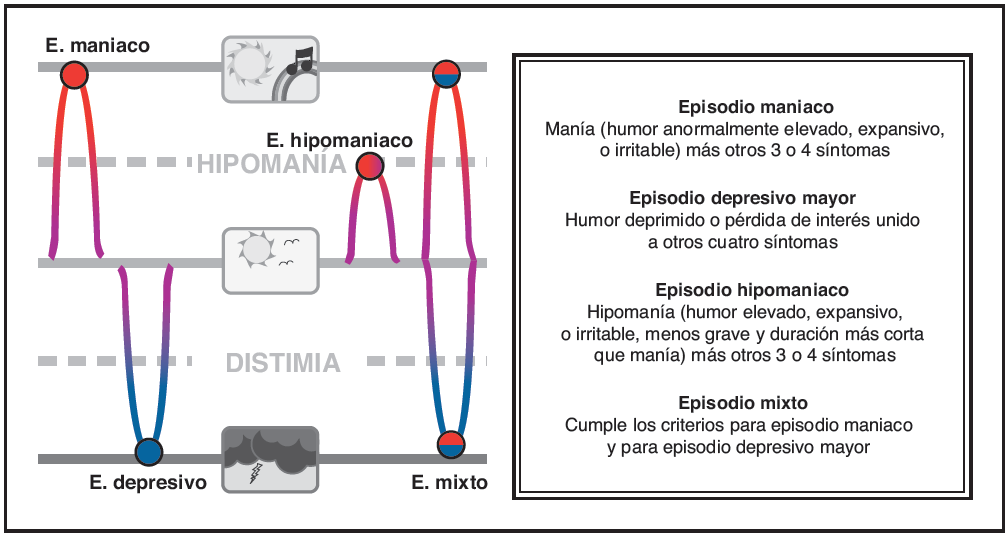
Episodios de humor. El trastorno bipolar generalmente se caracteriza por cuatro tipos de episodios de enfermedad: maniaco, depresivo mayor, hipomaniaco y mixto. Un paciente puede tener cualquier combinacio?n de estos episodios en el curso de la enfermedad; tambie?n pueden darse episodios subsindro?micos maniacos o depresivos durante el curso de la enfermedad, en cuyo caso no hay si?ntomas suficientes o los si?ntomas no son lo suficientemente graves para cumplir los criterios de diagno?stico para uno de estos episodios. Asi?, la presentacio?n de los trastornos del humor puede variar ampliamente.
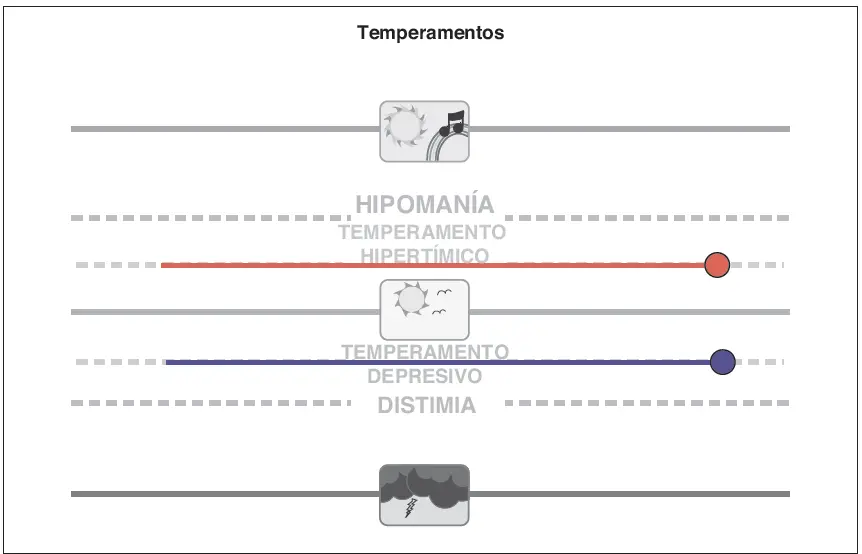
Temperamentos. No todas las variaciones del humor son patolo?gicas. Los individuos con temperamento depresivo pueden estar tristes o apa?ticos de manera consistente pero no cumplen los criterios para distimia y no experimentan necesariamente ninguna disfuncio?n funcional. Sin embargo, los individuos con temperamento depresivo podri?an tener un mayor riesgo de desarrollo de un trastorno del humor a lo largo de su vida. El temperamento hiperti?mico, en el que el humor se situ?a por encima de lo normal pero no de forma patolo?gica, incluye caracteri?sticas estables como extraversio?n, optimismo, exuberancia, impulsividad, exceso de confianza en uno mismo, grandiosidad y falta de inhibicio?n. Los individuos con temperamento hiperti?mico pueden tener un mayor riesgo de desarrollo de un trastorno del humor a lo largo de su vida.
Cada vez contamos con mayor evidencia que reconoce que muchos, o incluso la mayoría de los pacientes evaluados en la práctica clínica, pueden tener un trastorno del humor que no quede bien descrito por ninguna de las categorías resumidas anteriormente. Formalmente, se los podría denominar “no especificados” o “NE”, pero esto crea una gran categoría única para muchos pacientes que es desmentida por la riqueza y complejidad de sus síntomas. Cada vez más, dichos pacientes son contemplados como pertenecientes en general al “espectro bipolar”.
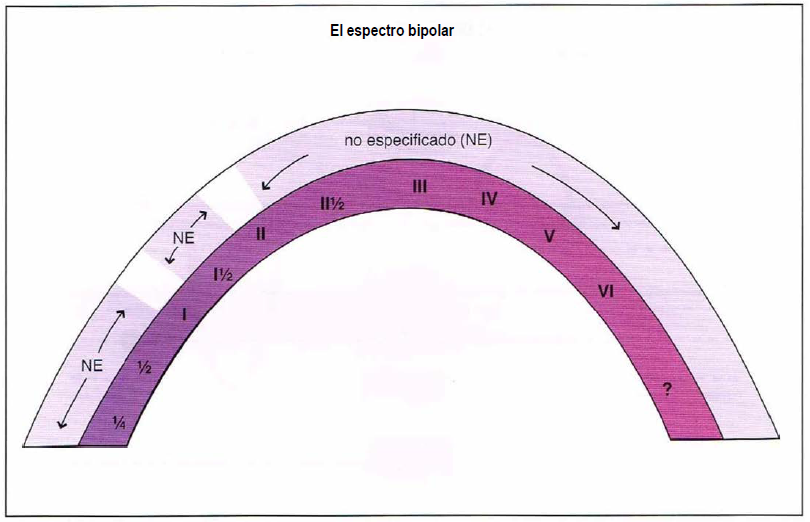
Espectro bipolar. Existe una tremenda variación en la presentación de pacientes con trastorno bipolar. Históricamente, el trastorno bipolar ha sido categorizado como I, II, o no especificado (NE). Puede ser más útil, en su lugar, pensar en estos pacientes como pertenecientes a un espectro bipolar e identificar subcategorías de presentaciones, como han hecho Akiskal y otros expertos.
Bipolar 1/4 (0,25)
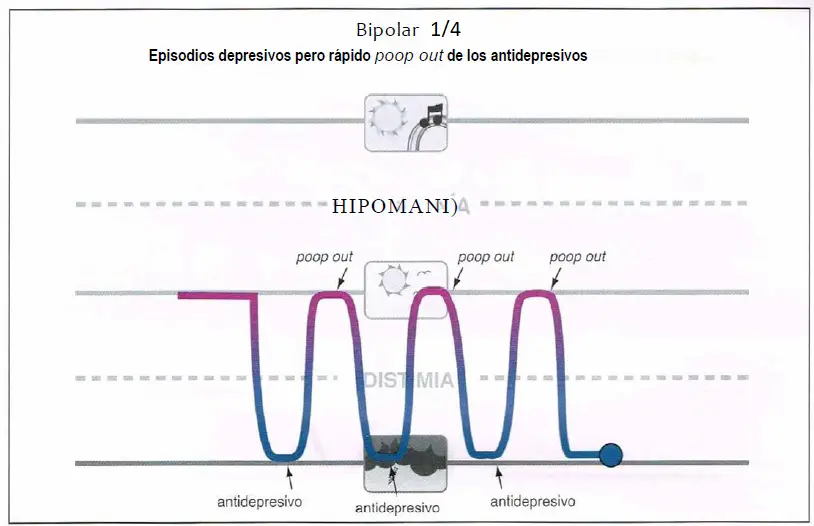
Bipolar 1/4. Algunos pacientes puede presentar síntomas depresivos y aún así exhibir una respuesta rápida aunque no mantenida al tratamiento antidepresivo (a veces denominado «poopout» rápido). Aunque esos pacientes podrían no tener síntomas de humor espontáneos por encima de lo normal, potencialmente se beneficiarían del tratamiento con estabilizadores del humor.
Bipolar ¼ (0,25)
- Un tipo inestable de depresión unipolar que a veces responde rápidamente, pero no de forma mantenida, a los antidepresivos (a esta respuesta se la suele denominar “poop-out” o agotamiento).
- Pacientes con un humor inestable, pero no bipolares.
- Funcionan los estabilizadores del humor añadidos a antidepresivos.
Bipolar 1/2 (0,5)
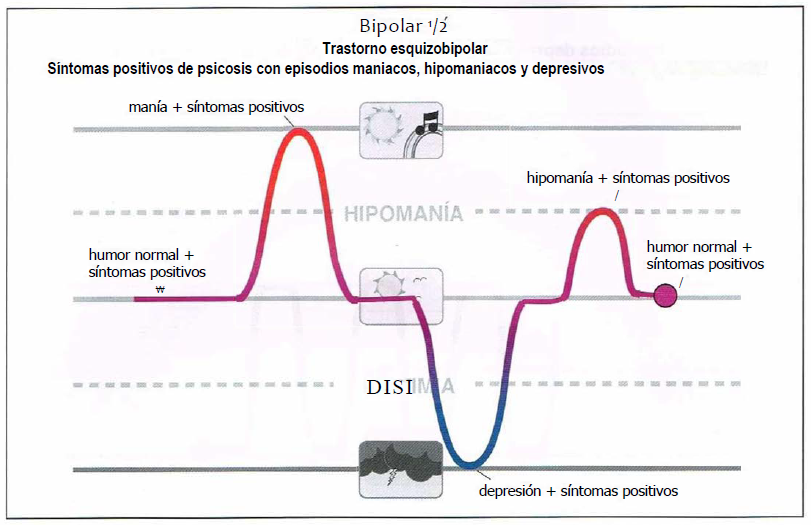
Bipolar 1/2. El bipolar 1/2 (0,5) ha sido descrito como trastorno esquizobipolar, que combina síntomas positivos de psicosis con episodios maniacos, hipomaniacos y depresivos.
Bipolar ½ (0,5)
- Trastorno esquizobipolar, combina síntomas positivos de psicosis con episodios maniacos, hipomaniacos y depresivos.
- La esquizofrenia y el trastorno bipolar han sido conceptualizados tanto como trastornos dicotómicos como pertenecientes a un proceso continuo.
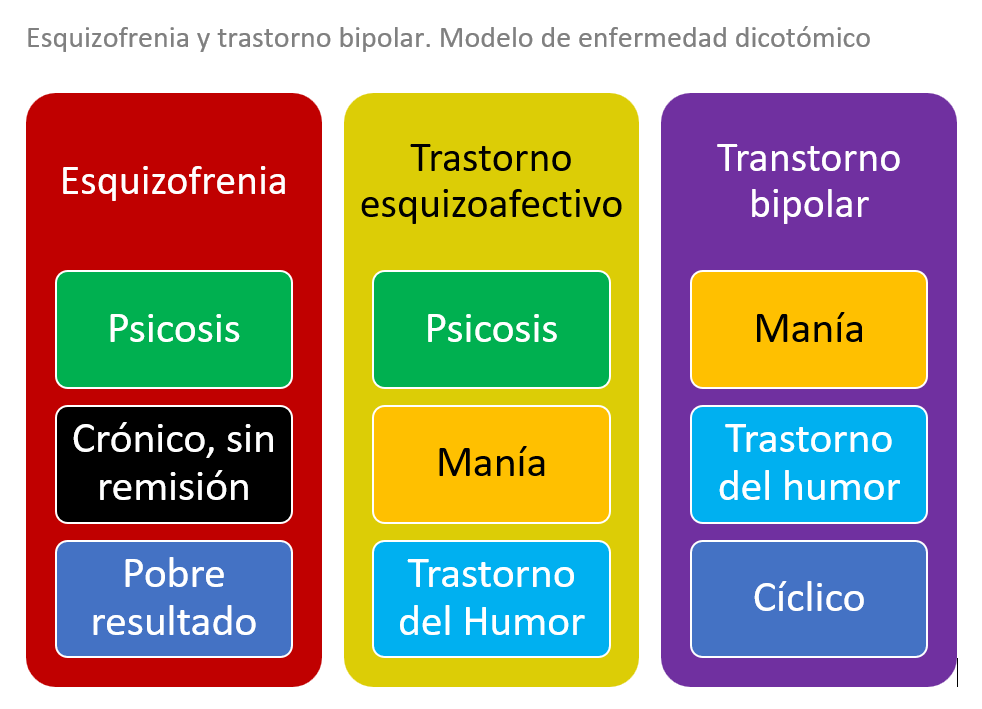
Esquizofrenia y trastorno bipolar: modelo de dicotómico. La esquizofrenia y el trastorno bipolar han sido conceptualizados como trastornos dicotómicos y dentro de una evolución continua. En el modelo de enfermedad dicotómico, la esquizofrenia consiste en psicosis crónica, sin remisión, con pobres resultados esperados. El trastorno bipolar consiste en episodios cíclicos maniacos y otros episodios del humor y tiene mejores expectativas de resultados que la esquizofrenia. Un tercer trastorno diferenciado es el esquizoafectivo, caracterizado por psicosis y manía así como otros síntomas del humor.
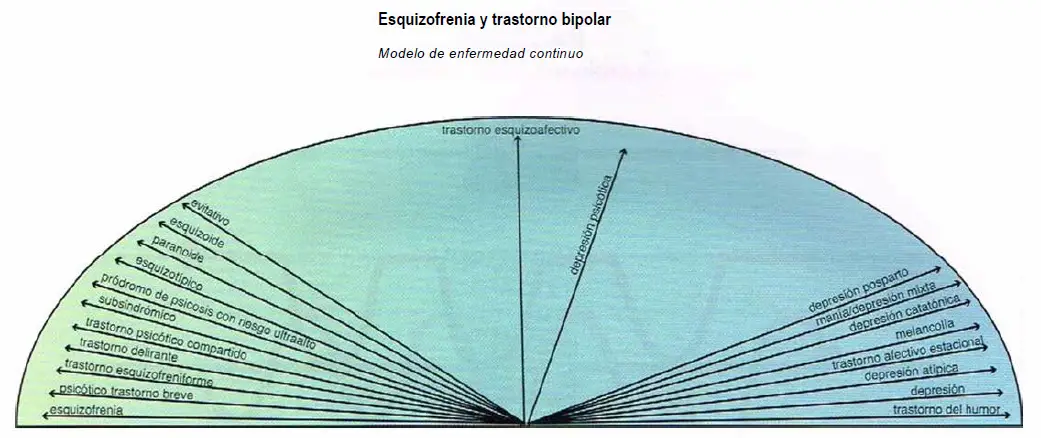
Esquizofrenia y trastorno bipolar: modelo de enfermedad continuo. La esquizofrenia y el trastorno bipolar han sido conceptualizados tanto como trastornos dicotómico y como pertenecientes a un proceso continuo. En el modelo de enfermedad continuo, la esquizofrenia y los trastornos del humor se establecen en un continuum en el que psicosis, delirios y conducta paranoide evitativa se sitúan en un extremo y depresión y otros síntomas del humor en el otro. En el medio se sitúa la depresión psicótica y el trastorno esquizoafectivo.
Los antipsicóticos atípicos son efectivos en:
- Los síntomas positivos de la esquizofrenia.
- La manía psicótica.
- La manía no psicótica.
- La depresión psicótica.
- La depresión bipolar.
- La depresión unipolar.
- Y también para el espectro de síntomas en trastornos esquizoafectivos.
Bipolar I 1/2 (1,5)
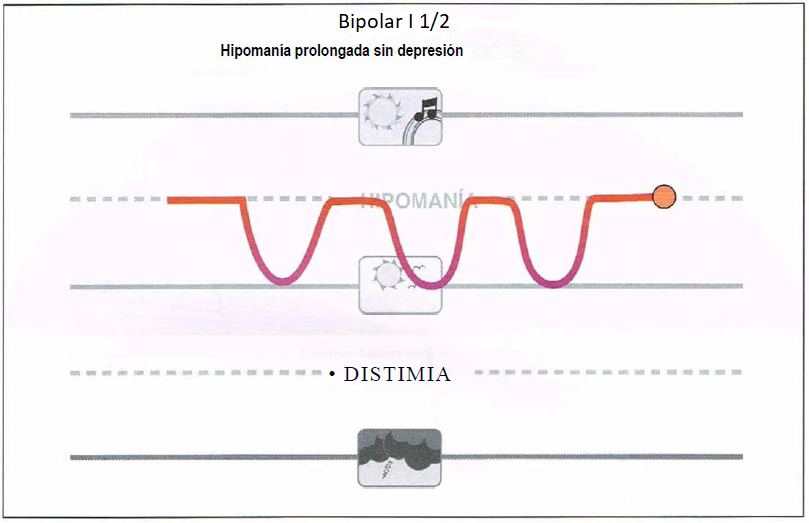
Bipolar I 1/2. El diagnóstico formal para el diagnóstico del trastorno bipolar II requiere formalmente la presencia no solo de episodios hipomaniacos sino también depresivos. Sin embargo, algunos pacientes pueden experimentar hipomanía recurrente sin haber experimentado un episodio depresivo (una presentación que puede denominarse bipolar I 1/2). Estos pacientes pueden tener riesgo de desarrollar un episodio depresivo y son candidatos para tratamiento con estabilizadores del humor, aunque no hay ningún tratamiento formalmente aprobado para esta condición.
Bipolar I 1/2
- Presentan hipomanía prolongada o recurrente sin depresión.
- Pueden beneficiarse de estabilizadores del humor.
- Vigilar la posible aparición de un episodio depresivo mayor.
Bipolar II 1/2 (2,5)
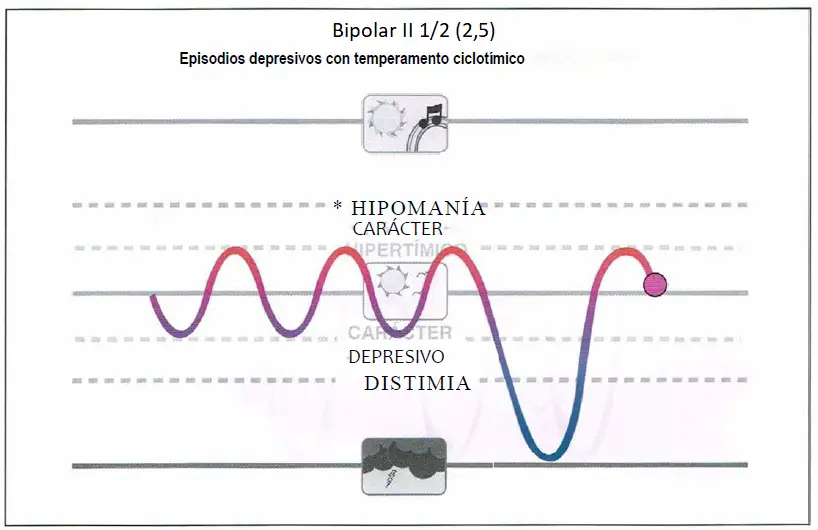
Bipolar II 1/2. Los pacientes pueden presentar un episodio depresivo mayor en el contexto de un temperamento ciclotímico, que se caracteriza por oscilaciones entre estados hipertímicos o hipomaniacos (por encima de lo normal) y estados depresivos o distímicos (por debajo de lo normal) entre las cuales se introduce un episodio depresivo mayor (bipolar II Vi). Los Individuos con temperamento ciclotímico que reciben tratamiento para los episodios depresivos mayores pueden tener un riesgo aumentado de delaciones del humor Inducidas por antidepresivos.
Bipolar II 1/2
- Ciclotímicos que desarrollan episodios depresivos mayores.
- Cuidado con dar antidepresivos porque pueden inducirles un episodio maníaco.
Bipolar III (3,0)
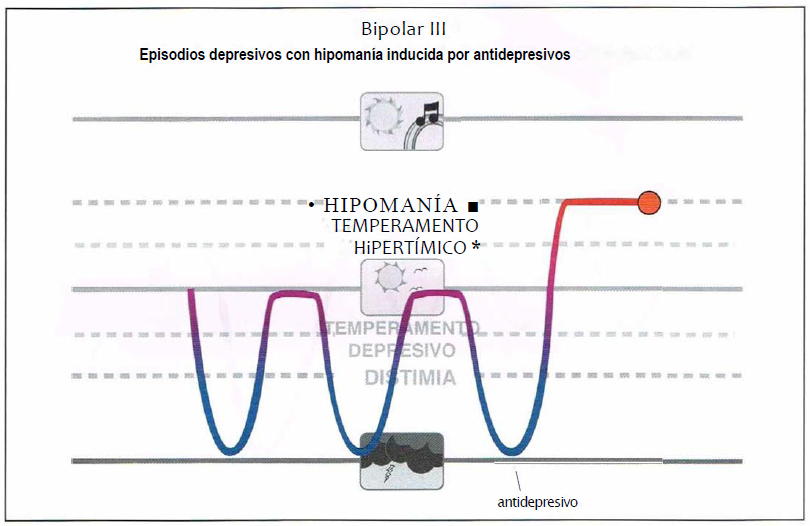
Bipolar III. Aunque el Manual Diagnóstico y Estadístico de los Trastornos Mentales, cuarta edición (DSM-IV), define (hipo)manía inducida por antidepresivos como un trastorno del humor inducido por sustancias, algunos expertos creen que los individuos que experimentan (hipo)manía inducido por sustancias en realidad están predispuestos a estos estados de humor y que, por tanto, pertenecen al espectro bipolar (bipolar III).
Bipolar III
- Desarrollan un episodio maníaco o hipomaníaco al ser tratados con un antidepresivo.
- No son buenos candidatos para monoterapia antidepresiva..
Bipolar III 1/2 (3,5)
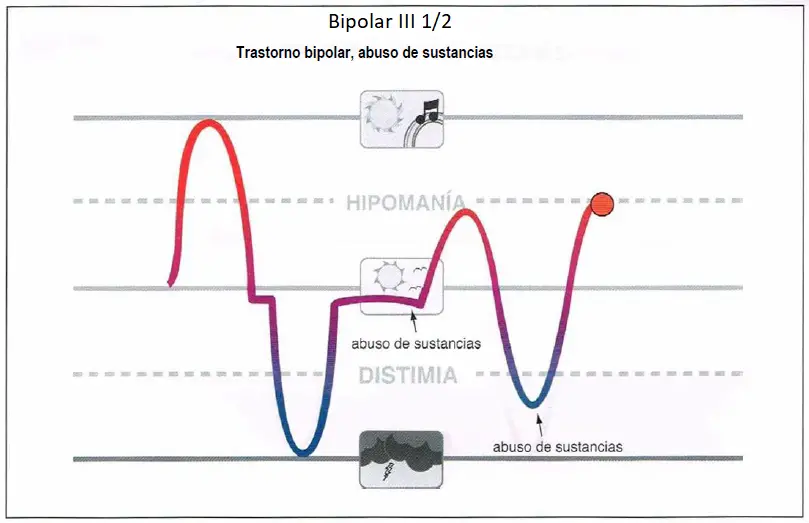
Bipolar III 1/2. Es un trastorno bipolar con abuso de sustancias, en el cual el abuso de sustancias se asocia al intento de provocar una hipomanía. Dichos pacientes deberían ser evaluados detenidamente para determinar si la (hipo)manía ha tenido lugar alguna vez en ausencia de abuso de sustancias.
Bipolar III 1/2
- Asociado al abuso de sustancias.
Bipolar IV (4,0)
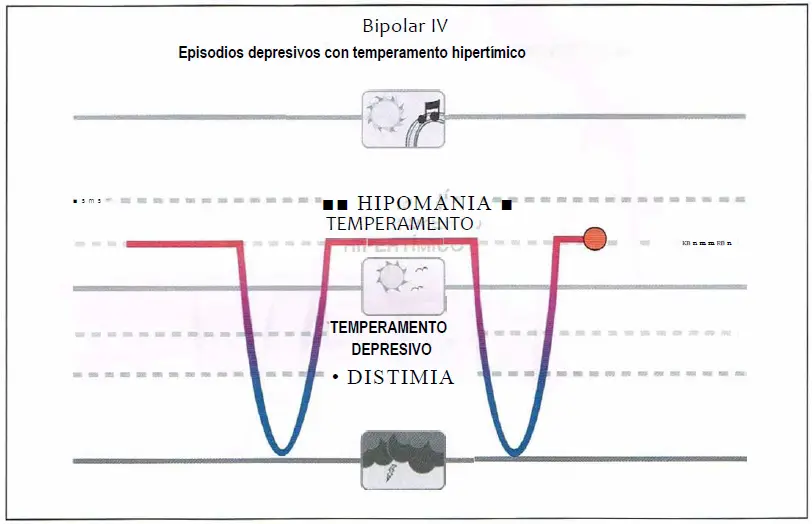
Bipolar IV. Corresponde a individuos con temperamento hipertímico estable y duradero en los que se desarrolla un episodio depresivo mayor. Los individuos con temperamento hipertímico que son tratados por episodios depresivos pueden tener un riesgo aumentado de oscilaciones del humor inducido por antidepresivos y pueden responder mejor a los estabilizadores del humor.
Bipolar IV
- Asociación de episodios depresivos y un temperamento hipertímico preexistente.
- Cuidado con los antidepresivos.
- Pueden responder mejor a los estabilizadores del humor.
Bipolar V (5,0)
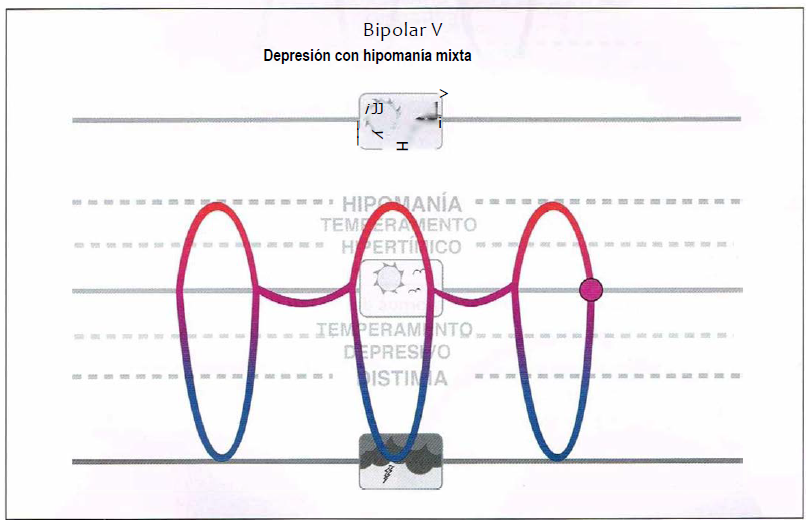
Bipolar V. Se define como episodios depresivos mayores con síntomas hipomaniacos durante el episodio depresivo mayor pero sin la presencia de episodios hipomaniacos específicos. Puesto que los síntomas no cumplen criterios estriaos de manía, no se diagnosticaría a estos pacientes de fase mixta, pero sin embargo conllevan una presentación mixta y pueden requerir tratamiento estabilizador del humor en lugar de monoterapia antidepresiva.
Bipolar V
- Asociación de episodios depresivos mayores con síntomas hipomaniacos durante el episodio depresivo mayor, pero sin la presencia de episodios hipomaniacos específicos.
- Pueden requerir tratamiento estabilizador del humor en lugar de monoterapia antidepresiva.
- Algunos expertos creen que más de la mitad de los pacientes con depresión mayor
también tienen una historia de hipomanía subsindrómica de por vida, y que estos pacientes tienen muchas más posibilidades de progresar hasta un diagnóstico bipolar
formal. - Los pacientes con depresión e hipomanía subumbral generalmente tienen un peor resultado, más episodios de humor, más incapacidad laboral, más probabilidad de tener un miembro de la familia con manía u otro trastorno bipolar y una aparición temprana de depresión.
- Para la depresión con hipomanía subsindrómica, sería más importante enfatizar la sobreactividad más que solo una elevación del humor.
- El hecho de que un paciente esté deprimido no significa que deba iniciar tratamiento
antidepresivo. Los pacientes con estados mixtos de depresión y manía serían particularmente vulnerables a la inducción de activación, agitación, ciclación rápida, disformia, hipomanía, manía o conducta suicida al ser tratados con antidepresivos, y más concretamente sin el uso simultáneo de un estabilizador del humor o un antipsicótico atípico.
Estados mixtos
(depresión + manía)
- Al ser tratados con antidepresivos sin el uso simultáneo de estabilizadores del humor o antipsicóticos típicos, son más vulnerables a:
- Activación.
- Agitación.
- Ciclación rápida.
- Hipomanía.
- Manía.
- Conducta suicida.
Bipolar VI (6,0)
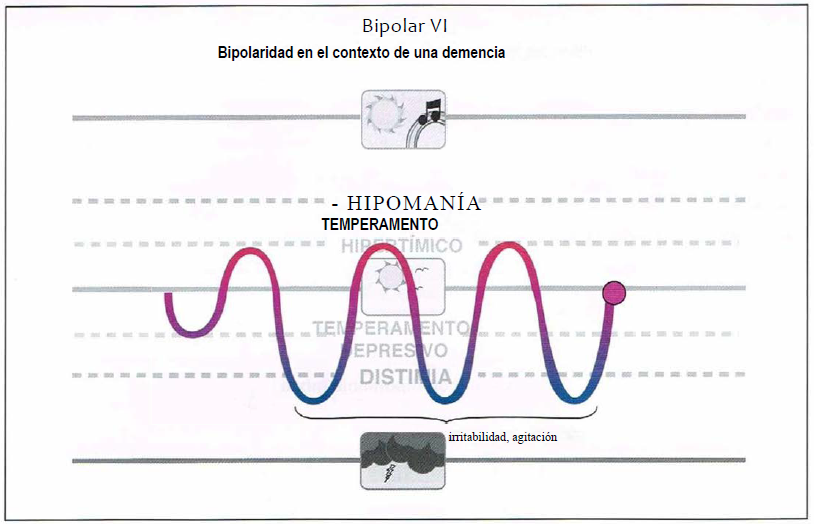
Bipolar VI. Otra subcategoría dentro del espectro bipolar puede ser la «bipolarídad en el contexto de una demencia”, llamada bipolar VI. La inestabilidad afectiva en este caso comienza a una edad tardía, seguida de alteraciones en la atención, irritabilidad, disminución de la energía y alteración del sueño. La presentación puede parecer inicialmente atribuible a la demencia o ser considerada una depresión unipolar, pero tiende a agravarse con antidepresivos y puede responder a estabilizadores del humor.
Bipolar VI (Bipolaridad en demencia)
- Bipolar VI.
- La sintomatología puede ser erróneamente atribuida a los síntomas conductuales de la demencia.
- Debería ser tratada con estabilizadores del humor o antipsicóticos atípicos.
MergedFile
Neurotransmisores y circuitos en trastornos del humor
Tres neurotransmisores principales han sido implicados desde hace tiempo tanto en la fisiopatología como en el tratamiento de los trastornos del humor. Se trata de la dopamina, la serotonina, y la norepinefrina (noradrenalina),y comprenden lo que a veces se denomina sistema de neurotransmisión monoaminérgico. Estas tres monoaminas a menudo funcionan conjuntamente. Muchos de los síntomas de los trastornos afectivos implican en teoría disfunción de varias combinaciones de estos tres sistemas. En esencia, todos los tratamientos conocidos para los trastornos del humor actúan sobre uno o más de estos tres sistemas de neurotransmisión monoaminérgico.
Repaso
Sistema dopaminérgico
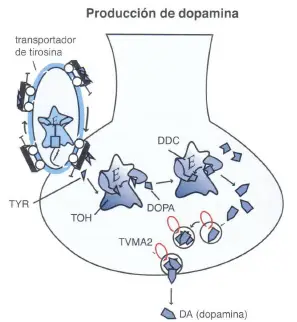
Síntesis de la dopamina. La tirosina (TYR), un precursor de la dopamina, es transportada al interior de los terminales nerviosos dopaminérgicos, vía transportador de tirosina, y convertida en DOPA, mediante la enzima tirosina hidroxilasa (TOH). La DOPA entonces es convertida en dopamina (DA) mediante la enzima DOPA decarboxilasa (DDC). Después de la síntesis, la dopamina es almacenada en vesículas sinápticas
gracias al transportador vesicular de monoaminas (TVMA2) y allí permanece hasta que es liberada en la sinapsis durante la neurotransmisión.
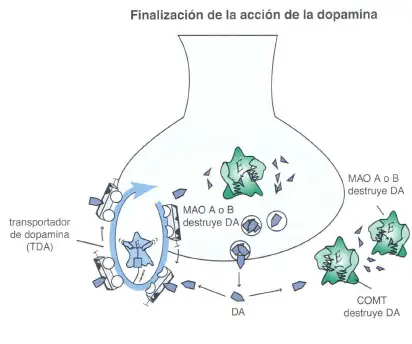
Finalización de la acción de la dopamina. La acción de la dopamina puede ser finalizada a través de múltiples mecanismos. La dopamina puede ser transportada fuera de la hendidura sináptica al interior de la presinapsis por medio del transportador de dopamina (TOA), donde puede ser realmacenada para un futuro uso. Alternativamente, la dopamina puede ser destruida en el espacio extracelular por la enzima catecol-0-metiltransferasa (COMT). Otras enzimas que pueden destruir la dopamina son la monoaminoxidasa A (MAO-A) y la monoaminoxidasa (MAO-B), que están presentes en la mitocondria dentro de la neurona presináptica y en otras células como las de la glía.
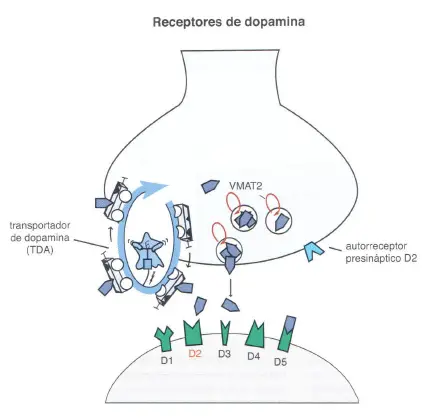
Receptores de dopamina. El transportador de dopamina (TOA) se encuentra en la presinapsis y es responsable de eliminar el exceso de dopamina en la sinapsis. El transportador vesicular de monoaminas (TVMA2) bombea dopamina al interior de las vesículas sinápticas para futuras neurotransmisiones. Hay, además, un receptor de dopamina del subtipo 2 en la presinapsis que funciona como autorreceptor, regulando la liberación de dopamina de la neurona presináptica. También hay varios tipos de receptores postsinápticos. Estos incluyen los receptores de dopamina de los subtipos 1, 2, 3, 4 y 5. Las funciones del receptor de dopamina-2 son las mejor estudiadas, porque es la zona principal de unión de prácticamente todos los agentes antipsicóticos así como de los agonistas dopaminérgicos usados en el tratamiento de la enfermedad de Parkinson.
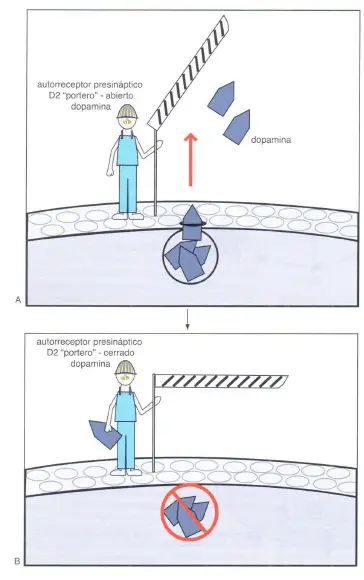
Autorreceptores presinápticos de dopamina 2 (D2). Los autorreceptores presinápticos D2 son como «porteros» de la dopamina. Es decir, cuando el receptor de la portería no está ligado a dopamina (no hay dopamina en la mano del portero), abren la barrera molecular, permitiendo la liberación de dopamina (A). Sin embargo, cuando la dopamina se une al receptor portero (ahora el portero tiene dopamina en la mano), cierran la barrera molecular e impiden la liberación de dopamina (B).

Autorreceptores presinápticos de dopamina-2. Los autorreceptores D2 pueden localizarse en el terminal axónico, como se muestra aquí. Cuando la dopamina se acumula en la sinapsis (A), se une al autorreceptor, que inhibe así la liberación de dopamina (B).
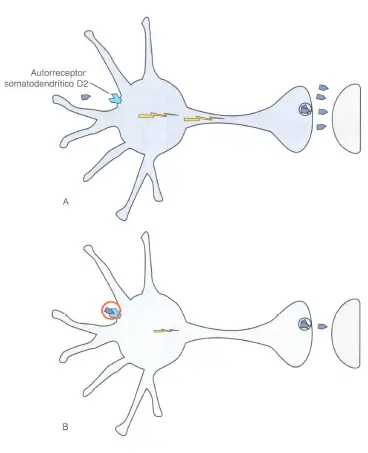
Autorreceptores somatodendríticos de dopamina-2. Los autorreceptores de dopamina-2 pueden también estar localizados en el área somatodendrítica, como se muestra aquí. Cuando la dopamina se une al receptor en esta área, se atenúa el flujo de impulsos en la neurona (véase la pérdida de impulsos eléctricos en la neurona en B), y esto detiene la liberación de más dopamina.
En ambos casos, la ocupación de los receptores D2 proporciona un fenómeno de retroalimentación negativo, o de freno, en la liberación de dopamina desde la neurona presináptica.
Principales vías dopaminérgicas del cerebro
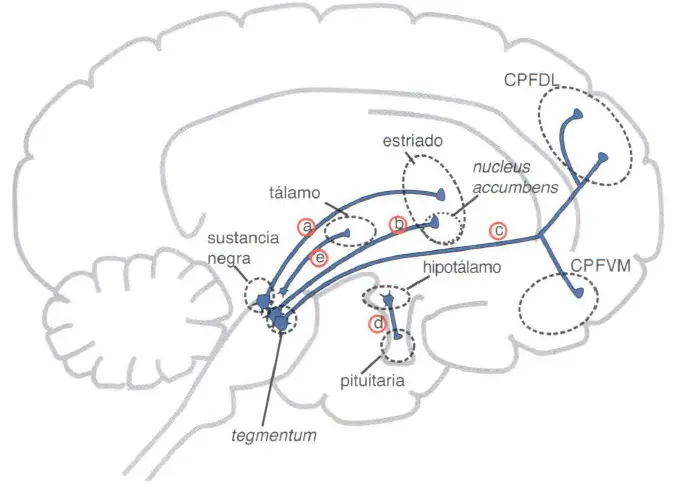
El conocimiento de la neuroanatomía de las vías neuronales dopaminérgicas en el cerebro puede ayudar a explicar los síntomas de la esquizofrenia, así como los efectos terapéuticos y los efectos secundarios de los fármacos antipsicóticos. Hay 5 vías dopaminérgicas principales:
- La vía dopaminérgica nigroestriada (a), que se proyecta desde la sustancia negra a los ganglios basales o estriado, es parte del sistema nervioso extrapiramidal y controla funciones motoras y movimiento.
- La vía dopaminérgica mesolímbica (b), se proyecta desde el área tegmental ventral del mesencéfalo al nucleus accumbens, una parte del sistema límbico del cerebro que se cree que gestiona múltiples funciones como las sensaciones placenteras, la potente euforia de las drogas de abuso así como la producción de delirios y alucinaciones en la psicosis.
- La vía dopaminérgica mesocortical (c), esta relacionada con la vía dopaminérgica mesolímbica. Se proyecta desde el área tegmental ventral del mesencéfalo a áreas del córtex prefrontal, donde puede desarrollar un papel importante en la producción de síntomas cognitivos (córtex prefrontal dorsolateral) y de síntomas afectivos (córtex prefrontal ventromedial) en la esquizofrenia.
- La vía dopaminérgica tuberoinfundibular (d), se proyecta desde el hipotálamo a la glándula hipofisiaria anterior y controla la secreción de prolactina.
- La quinta vía dopaminérgica (e) surge de múltiples sitios, como la sustancia gris periacueductal, el mesencéfalo ventral, de núcleos hipotalámicos y del núcleo parabraquial lateral y desde estos, se proyecta al tálamo. Su función no se conoce bien en la actualidad.
Repaso
Sistema serotoninérgico
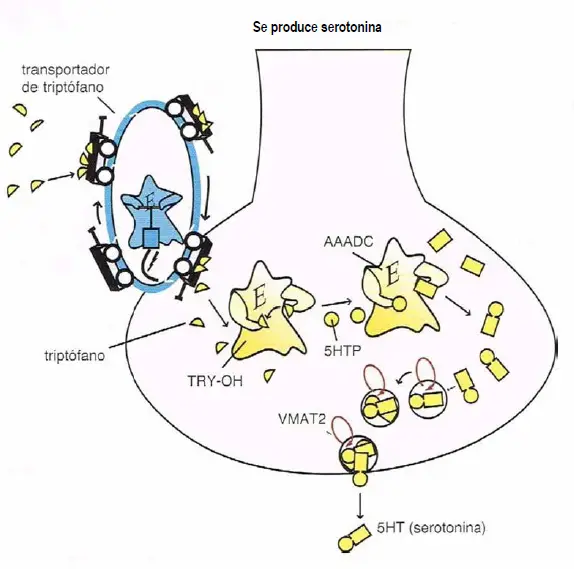
Síntesis de la serotonina. La serotonina 5-hidroxitriptamina o 5HT es producida a partir de enzimas tras el transporte del aminoácido precursor triptófano dentro de la neurona de serotonina. El transportador de triptófano es distinto del de la serotonina. Una vez transportado dentro de la neurona serotoninérgica, el triptófano es transformado por la enzima triptófano hidroxilasa (TRY-OH) en 5-hidroxitriptófano (5HTP), el cual es convertido entonces por la enzima aminoácido aromática decarboxilasa (AAADC) en 5HT. La serotonina es transportada a vesículas sinápticas posteriormente a través del transportador vesicular monoamina (VMAT2), donde permanece hasta ser liberada por un impulso neuronal.
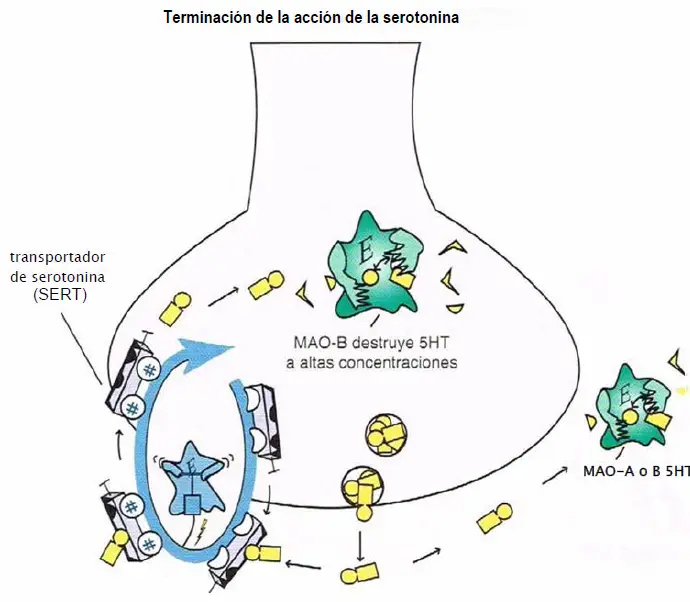
Terminación de la acción de la serotonina. La acción de la serotonina (5HT) es terminada por las enzimas monoaminaoxldasa A (MAO A) y B (MAO B) fuera de la neurona y por la MAO B dentro de la neurona cuando está presente en concentraciones elevadas. Estas enzimas transforman la serotonina en un metabolito Inactivo. También hay un transporte selectivo presináptico para la serotonina, llamado transportador de serotonina o SERT, que lleva a la serotonina fuera de la sinapsis de vuelta a la neurona presináptica.
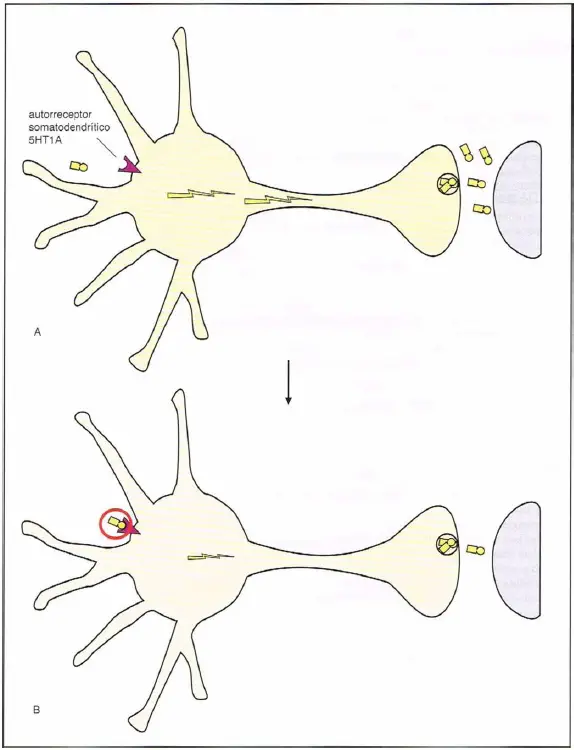
Autorreceptores 5HT1A. (A) Los receptores presinápticos 5HT1A son autorreceptores localizados en el cuerpo celular y las dendritas, denominándose, por tanto, autorreceptores somarodendríticos. (B) Cuando la serotonina (5HT) se une a los receptores 5HT1A, provoca un corte en el flujo neuronal del 5HT, representado aquí como una disminución de la actividad eléctrica y una reducción en la liberación de 5HT en la sinapsis de la derecha.
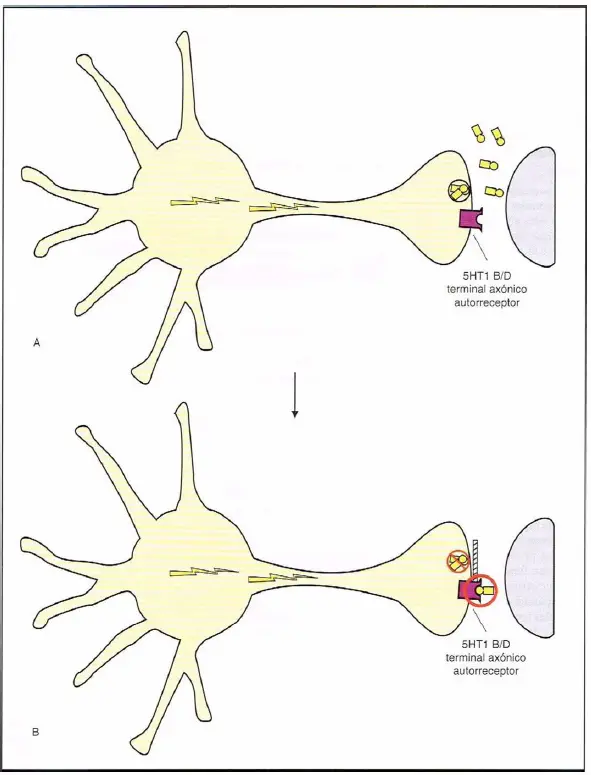
Autorreceptores 5HT1B/D. (A) Los receptores 5HT1B/D presinápticos son autorreceptores localizados en el terminal axónico presináptico. Actúan detectando la presencia de serotonina (5HT) en la sinapsis causando un cierre de la liberación de 5HT. (B) Cuando se acumula 5HT en la sinapsis (A), está disponible para unirse al autorreceptor, que entonces inhibe la liberación de serotonina.
Neuronas noradrenérgicas
La neurona noradrenérgica utiliza la norepinefrina (noradrenalina) como neurotransmisor. La norepinefrina (NE) es sintetizada o producida a partir del precursora aminoácido tirosina, que es transportado desde la sangre al sistema nervioso mediante una bomba de transporte activo.
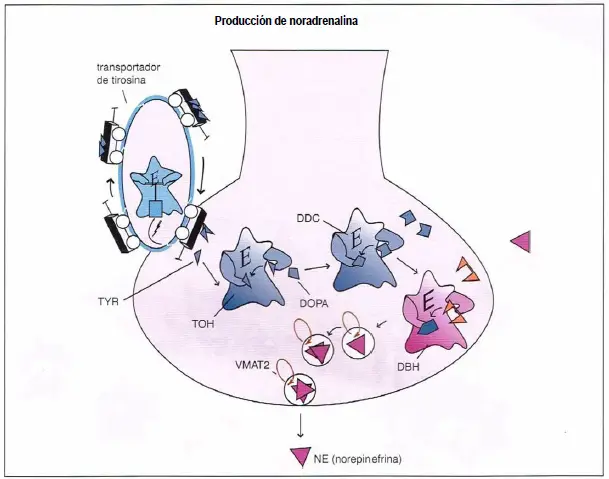
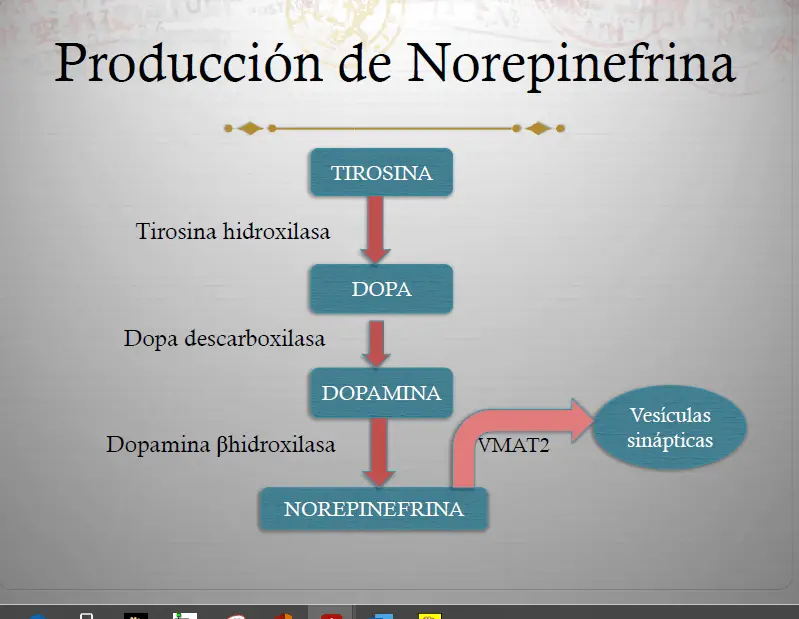
Producción de norepinefrina. La tirosina (TYR), un precursor de la norepinefrina (NE), es introducida en los terminales nerviosos NE por un transportador de tirosina y convertida en DOPA por la enzima tirosina hidroxilasa (TOH). La DOPA es convertida entonces en dopamina (DA) por la enzima DOPA decarboxilasa (DDC). Finalmente, la DA es transformada en NE por la dopamina beta hidroxilasa (DBH). Después de la síntesis, la NE es almacenada en vesículas sinápticas por el transportador vesicular de monoaminas (VMAT2), donde permanece hasta su liberación en la sinapsis durante la neurotransmisión.
La bomba de transporte que acaba con la acción sináptica de la NE se denomina en algunas ocasiones “transportador NE” o “NET”, y en otras, “bomba de recaptación de NE”. Esta bomba de recaptación de la NE se localiza en el terminal nervioso presináptico noradrenérgico como parte de la maquinaria presináptica de la neurona, donde actúa como una aspiradora que se lleva la NE fuera de la sinapsis, lejos de los receptores sinápticos, e interrumpe sus acciones sinápticas. Una vez dentro del terminal nervioso presináptico, la NE puede o bien ser almacenada de nuevo para una reutilización posterior cuando llegue otro impulso nervioso, o bien ser destruida mediante enzimas metabolizadoras de NE
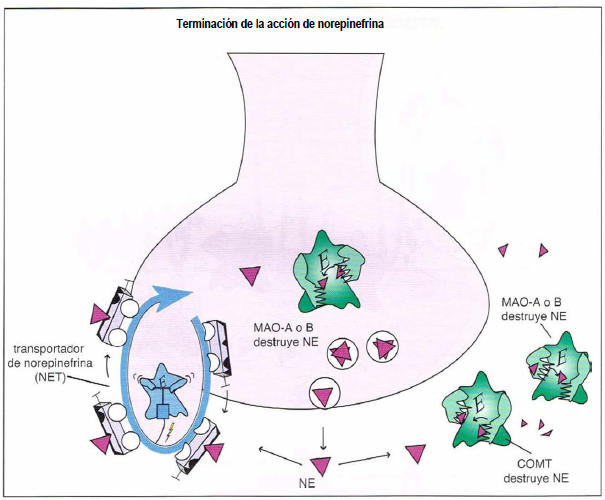
Terminación de la acción de norepinefrina. La acción de la norepinefrina puede finalizar por múltiples mecanismos. La norepinefrina puede ser transportada fuera de la hendidura sináptica y volver a la neurona presináptica a través del transportador de norepinefrina (NET), donde puede ser almacenada de nuevo para acciones futuras. De forma alternativa, la norepinefrina puede ser destruida extracelularmente por la enzima catecol-O-metil-transferasa (COMT). Otras enzimas que destruyen la norepinefrina son la monoaminooxidasa A (MAO-A) y monoaminooxidasa B (MAO-B), que están presentes en las mitocondrias dentro de la neurona presináptica y en otras células, incluidas neuronas y células gliales.
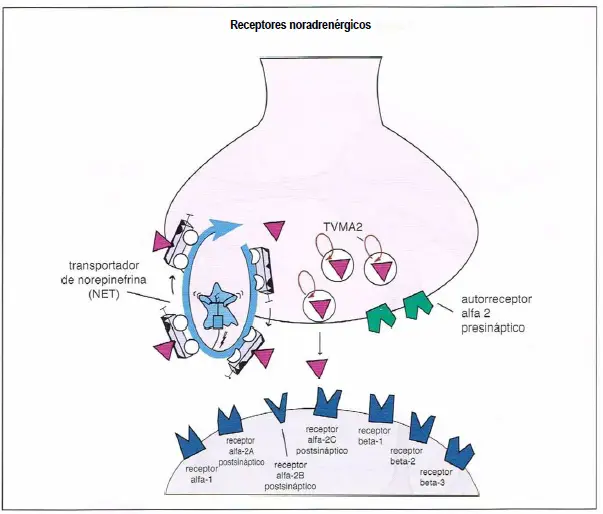
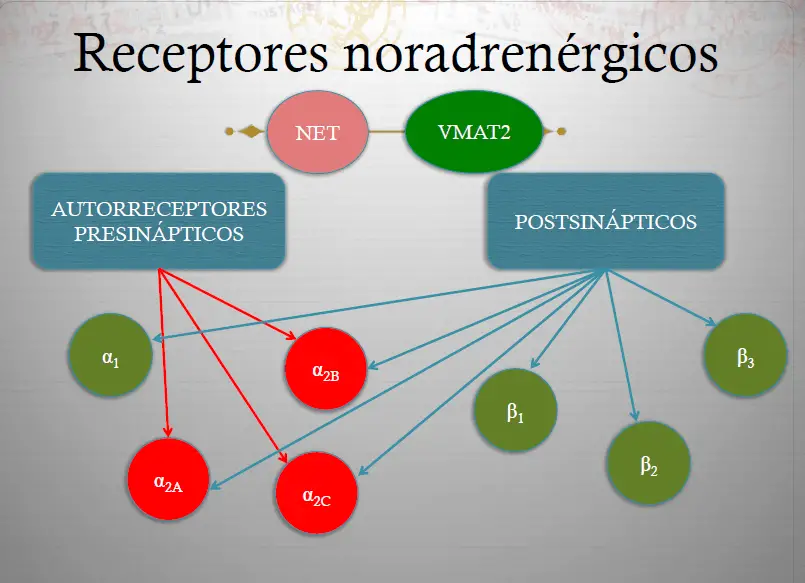
Receptores noradrenérgicos. Aquí se muestran los receptores de la norepinefrina que regulan su neurotransmisión. El transportador de norepinefrina (NET) se localiza presinápticamente y es responsable de retirar el exceso de norepinefrina de la sinapsis. El transportador vesicular de monoaminas (VMAT2) introduce la norepinefrina en las vesículas sinápticas y la almacena para futuras neurotransmisiones. Existe también un autorreceptor ?2 presináptico, que regula la liberación de norepinefrina desde la neurona presináptica. Además, existen vados receptores postsinápticos. Estos incluyen los receptores ?1, ?2A, ?2B, ?2C, ?1, ?2 y ?3.
La norepinefrina regula las neuronas noradrenérgicas por medio de los receptores ?2.
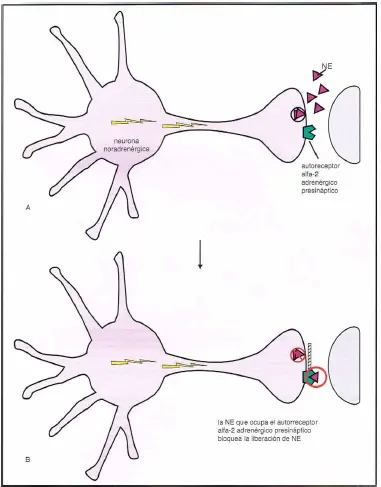
Receptores ?2 en el terminal axónico. Aquí se muestran los autorreceptores ?2-adrenérgicos presinápticos localizados en el terminal axónico de la neurona noradrenérgica. Estos autorreceptores son como «porteros» para la noradrenalina.
- (A) Cuando no están ocupados por noradrenalina, están abiertos, permitiendo la liberación de noradrenalina.
- (B) Cuando la noradrenalina se acopla a los receptores porteros, cierran la entrada molecular y evitan que a noradrenalina sea liberada.
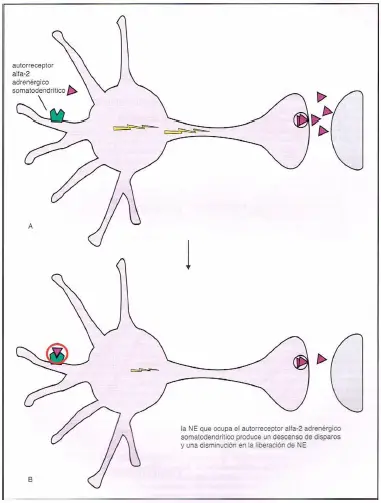
Receptores ?2 somatodendríticos. Los autorreceptores ?2-adrenérgicos presinápticos se localizan también en el área somatodendrítica de la neurona noradrenérglca. Cuando la norepinefrlna se une a estos receptores ?2, corta el impulso neuronal en la neurona noradrenérgica, y esto detiene la liberación de noreprepinefrina.
Power Point Profesora Alicia Ferrer Vadell
Interacciones monoaminérgicas: regulación NE de la liberación de 5HT
Ahora mostramos cómo la norepinefrina regula las neuronas 5HT de forma recíproca vía receptores ?1 y ?2.
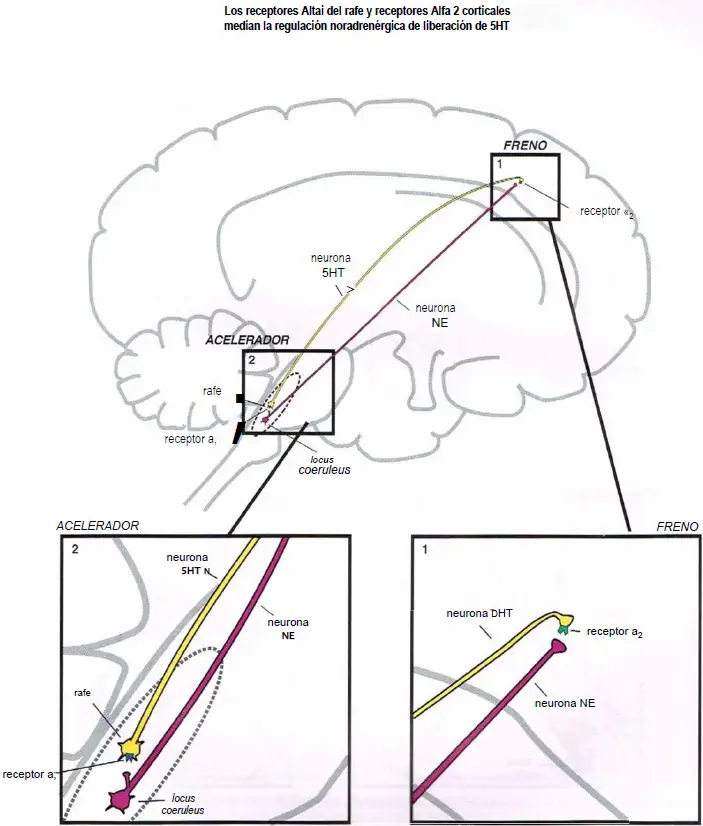
Los receptores alfa median la regulación noradrenérgica de la liberación de serotonina.
- (1) Actuando como un freno de la liberación de serotonina en los receptores ?2 corticales de los terminales axónicos.
- (2) Actuando como un acelerador de la liberación de serotonina en los receptores ?1 del área somatodendrítica.
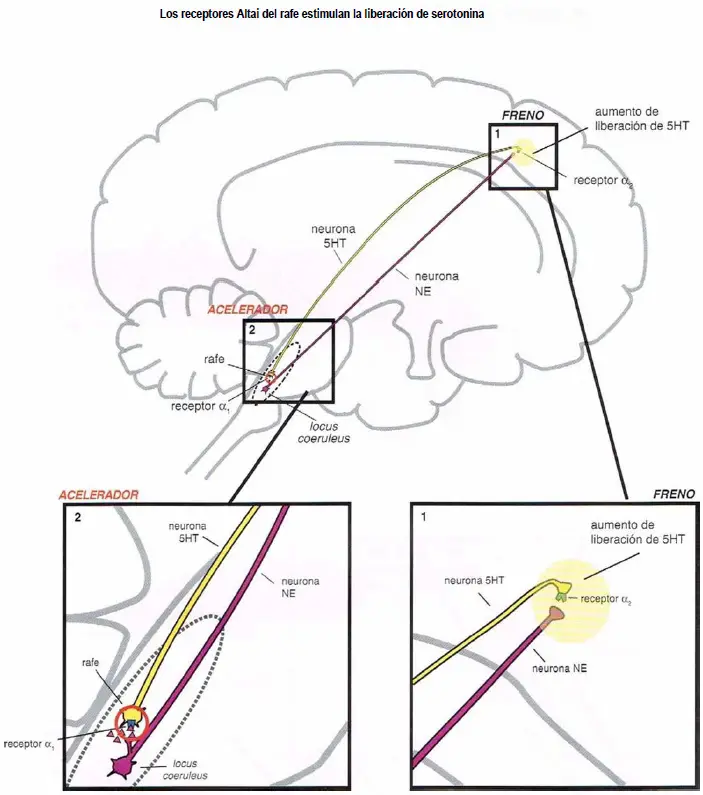
Los receptores alfa 1 del rafe estimulan la liberación de serotonina. Cuando estos receptores están desocupados por la norepinefrina, algo de serotonina es liberado desde la neurona de serotonina. Sin embargo, cuando la norepinefrina se une al receptor ?1 (2), esto estimula la neurona serotoninérgica, acelerando la liberación de serotonina (1).
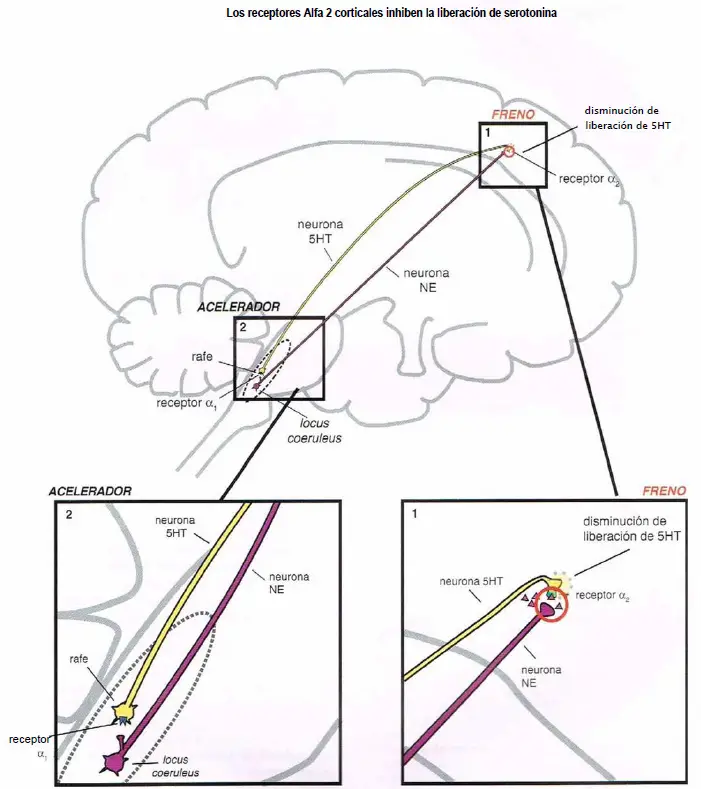
Los receptores ?2 corticales inhiben la liberación de serotonina. Los heterorreceptores ?2-drenérgicos se sitúan en los terminales axónicos de las neuronas serotoninérgicas (2). Cuando la norepinefrina se une al receptor ?2 se impide la liberación de serotonina (1).
- La función de los autorreceptores ?2 probablemente sea impedir una sobreestimulación de la neurona noradrenérgica.
- Los fármacos pueden no solo imitar el funcionamiento natural de la neurona noradrenérgica
estimulando el ?2, sino que los antagonistas pueden cortar el cable de freno y aumentar la liberación de norepinefrina (NE).
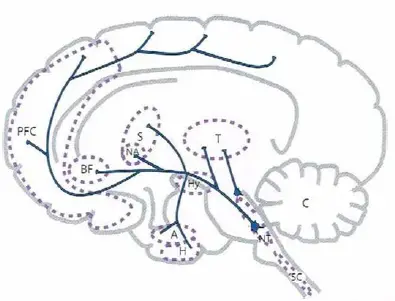
Principales proyecciones dopaminérgicas. La dopamina tiene amplias proyecciones ascendentes que se originan predominantemente en el tallo cerebral (particularmente en el área ventral tegmental y substanrla nigra) y se extienden vía hipotálamo hasta el córtex prefrontal, prosencéfalo basal, estriado, nucleus accumbens, y otras regiones. La neurotransmisión dopaminérgica está relacionada con el movimiento, el placer y la recompensa, la cognición, la psicosis, y otras funciones. Además, hay proyecciones directas desde otras zonas al tálamo, creando el «sistema talámico dopaminérgico», que posiblemente interviene en la activación y en el sueño.
- PFC, córtex prefrontal
- BF, prosencéfalo basal
- S, estriado
- NA, nucleus accumbens
- T, tálamo
- Hy, hipotálamo
- A, amígdala
- H, hipocampo
- NT, centros neurotransmisores del tallo cerebral
- SC, médula espinal
- C, cerebelo
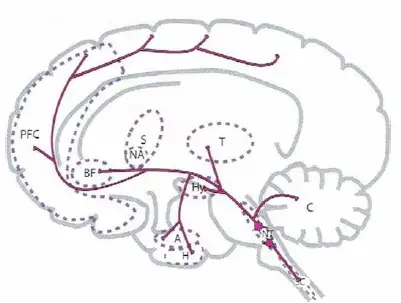
Principales proyecciones de la norepinefrina. La norepinefrina tiene proyecciones ascendentes y descendentes. Las proyecciones noradrenérgicas ascendentes se originan principalmente en el locus coeruleus del tallo cerebral; se extienden a múltiples regiones cerebrales, tal como aquí se muestra y regulan el humor, la activación, la cognición y otras funciones. Las proyecciones noradrenérgicas descendentes se extienden hacia abajo de la médula espinal y regulan las vías del dolor.
- PFC, córtex prefrontal
- BF, prosencéfalo basal
- S, estriado
- NA, nucleus accumbens
- T, tálamo
- Hy, hipotálamo
- A, amígdala
- H, hipocampo
- NT, centros neurotransmisores del tallo cerebral
- SC, médula espinal
- C, cerebelo
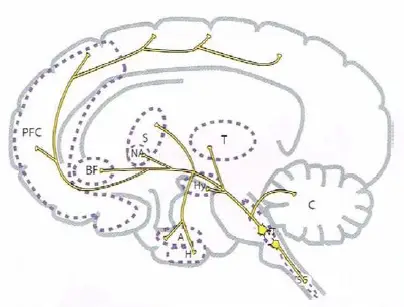
Principales proyecciones serotoninérgicas. Como la norepinefrina, la serotonina tiene proyecciones ascendentes y descendentes. Las proyecciones serotoninérgicas ascendentes se originan en el tallo cerebral y se extienden a muchas de las mismas regiones que las proyecciones noradrenérgicas, con proyecciones adicionales al estriado y nucleus accumbens. Esas proyecciones ascendentes pueden regular el humor, la ansiedad, el sueño, y otras funciones. Las proyecciones serotoninérgicas descendentes se extienden hacia abajo del tallo cerebral y a través de la médula espinal; podrían regular el dolor.
- PFC, córtex prefrontal
- BF, prosencéfalo basal
- S, estriado
- NA, nucleus accumbens
- T, tálamo
- Hy, hipotálamo
- A, amígdala
- H, hipocampo
- NT, centros neurotransmisores del tallo cerebral
- SC, médula espinal
- C, cerebelo
MergedFile
La hipótesis monoaminérgica de la depresión
La teoría clásica acerca de la etiología biológica de la depresión hipotetiza que la depresión se debe a una deficiencia de neurotransmisores monoaminérgicos. Inicialmente, se produjo una gran discusión acerca de si existía una deficiencia más importante de norepinefrina (NE) o bien de serotonina (5-hidroxitriptamina; 5HT), y la dopamina fue relativamente dejada de lado. Actualmente, la teoría monoaminérgica sugiere que el sistema de neuro- transmisión trimonoaminérgico en su conjunto puede ser disfuncional en varios circuitos cerebrales, con diferentes neurotransmisores implicados dependiendo del perfil sintomático del paciente.
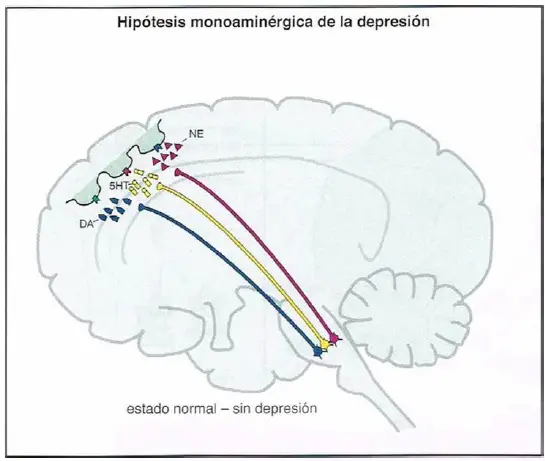
Hipótesis clásica de la monoamina en la depresión, parte 1. Cuando hay una cantidad «normal» de actividad de neurotransmisor monoaminérgico, no hay presencia de depresión.
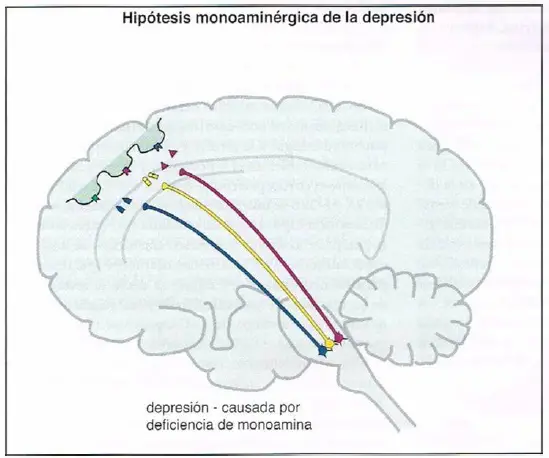
Hipótesis clásica de la monoamina en la depresión, parte 2. La hipótesis monoaminérgica de la depresión propone que si la cantidad «normal» de actividad de neurotransmisor monoaminérgico se reduce, se agota, o queda disfuncional por cualquier motivo, la depresión podría aparecer.
No se dispone todavía de evidencias directas que apoyen la hipótesis monoaminérgica. Se realizó un gran esfuerzo, especialmente en la década de 1960 y en la de 1970, para identificar las deficiencias teóricas de los neurotransmisores monoaminérgicos en depresión y su exceso en manía. Hasta la fecha este esfuerzo, desafortunadamente, ha producido resultados mixtos y a veces confusos, abriendo la puerta a la investigación de mejores explicaciones del vínculo potencial entre monoaminas y trastornos del humor.
MergedFile
La hipótesis del receptor monoaminérgico y expresión génica
Debido a la ausencia de evidencias respecto a la hipótesis monoaminérgica de la depresión, la atención de las hipótesis acerca de la etiología de la depresión se ha trasladado desde los propios neurotransmisores monoaminérgicos hacia sus receptores y los posteriores eventos moleculares que estos receptores desencadenan, incluida la regulación de la expresión génica y el papel de los factores del crecimiento.
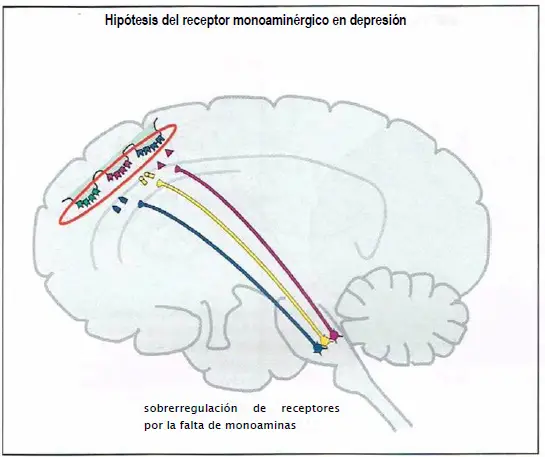
Hipótesis del receptor monoaminérgico en depresión. Esta hipótesis extiende la hipótesis clásica de la monoamina en depresión, proponiendo que una actividad deficiente de los neurotransmisores monoaminérgicos causa sobrerregulación de receptores de neurotransmisores monoaminérgicos postsinápticos, dando lugar a la depresión.
La Hipótesis del receptor monoaminérgico en la depresión postula que una disminución de neurotransmisores monoaminérgicos (NE, 5HT y DA), produce una sobrerregulación (al alza) de receptores monoaminérgicos postsinápticos y finalmente depresión. No hay evidencias claras que respalden esa hipótesis.
MergedFile
Estrés y depresión
Estrés, BDNF y atrofia cerebral en depresión
Un mecanismo que ha sido propuesto como el lugar de un posible fallo en la transducción de la señal desde los receptores monoaminérgicos es el gen objetivo del factor neurotrófico derivado del cerebro (BDNF)
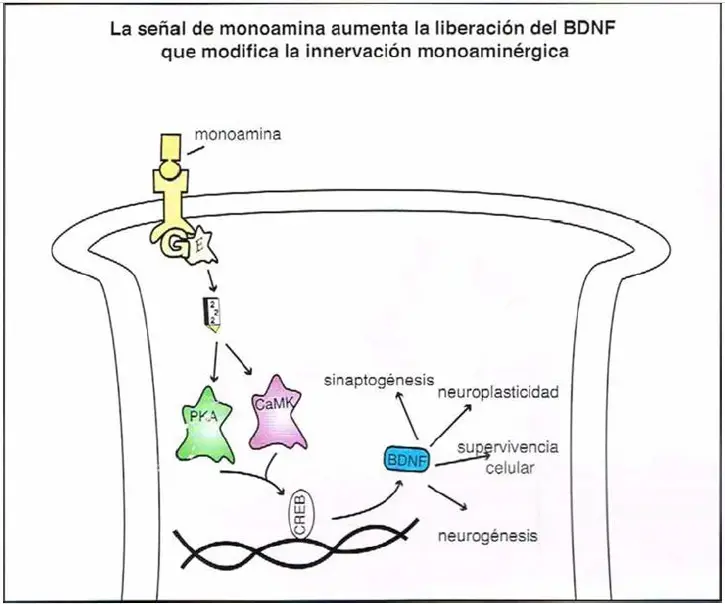
La señal de monoamina y la liberación del factor neurotrófico derivado del cerebro (BDNF). La
hipótesis neurotrófica de la depresión establece que la depresión estaría provocada por una reducción de la síntesis de proteínas implicadas en la neurogénesis y la plasticidad sináptica. El BDNF fomenta el crecimiento y desarrollo de las neuronas inmaduras, Incluyendo las monoaminérgicas, refuerza la supervivencia y función de neuronas adultas y ayuda a mantener las conexiones sinápticas Dado que el BDNF es importante para la supervivencia neuronal, el descenso de sus niveles podría contribuir a una atrofia celular. En algunos casos, los bajos niveles de BDNF pueden incluso causar pérdida celular. Las monoaminas pueden aumentar la disponibilidad de BDNF iniciando cascadas de transducción de señal que dan lugar a su liberación. Así, si los niveles de monoamina son bajos, entonces los niveles de BDNF podrían ser bajos en consecuencia. CaMK, proteína quínasa regulada por calcio/calmodulina; CREB, proteína de unión a elemento de respuesta CaMP; PKA, proteína quinasa A.
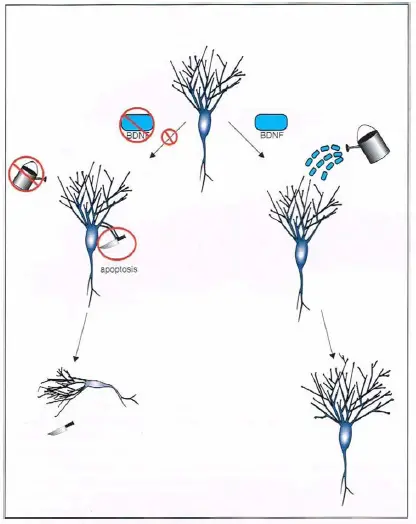
Producción de la supresión del factor neurotrófico derivado del cerebro (BDNF). El BDNF desempeña un papel importante en el crecimiento correcto y el mantenimiento de neuronas y conexiones neuronales (derecha). Si los genes del BDNF están desconectados (izquierda), el descenso resultante de BDNF podría comprometer la capacidad del cerebro de crear y mantener las neuronas y sus conexiones. Esto podría dar lugar a una pérdida de sinapsis o incluso de neuronas enteras por apoptosis.
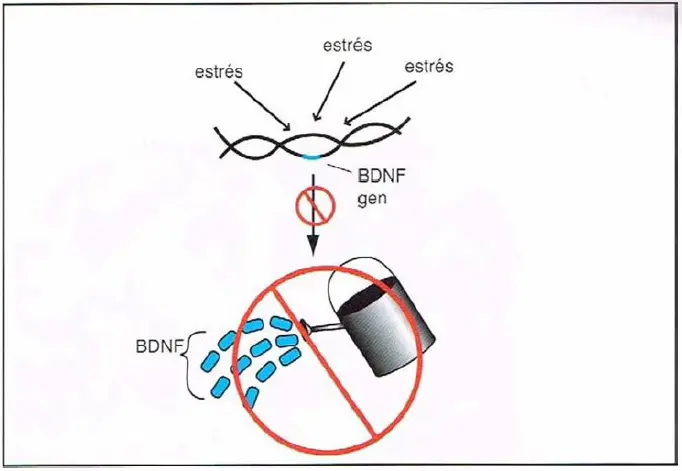
Estrés y factor neurotrófico derivado del cerebro (BDNF). Un factor que puede contribuir a una potencial atrofia del cerebro es el impacto que puede tener el estrés crónico sobre el BDNf, que tiene un importante papel en el correcto crecimiento y mantenimiento de neuronas y conexiones neuronales. Durante el estrés crónico, los genes del BDNf pueden quedar desconectados, reduciendo potencialmente su producción.
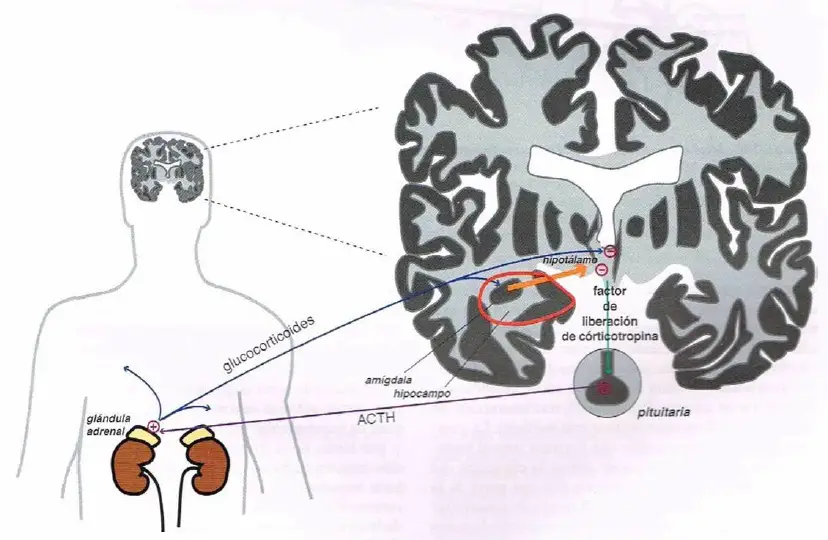
El eje hipotalámico-pituitaria-adrenal (HPA).La respuesta a estrés normal implica la activación del hipotálamo y un aumento resultante del factor de liberación de corticotropina (CRF), que a su vez estimula la liberación de la hormona adrenocorticotrópica (ACTH) desde la pituitaria. La ACTH causa liberación glucocorticoide desde la glándula adrenal, que alimenta de vuelta al hipotálamo e inhibe la liberación de CRF, terminando la respuesta al estrés.
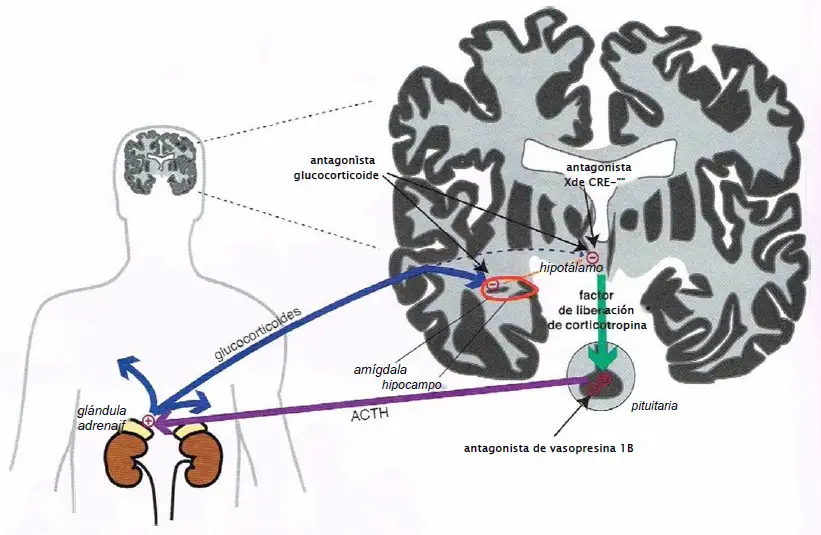
Atrofia hipocampal y eje HPA hiperactivo en depresión. En situaciones de estrés crónico, la excesiva liberación de glucocorticoide puede llegar a causar atrofia hipocampal. Dado que el hipocampo inhibe el eje HPA, la atrofia en esta región podría dar lugar a una activación crónica el eje HPA, lo que podría aumentar el riesgo de desarrollar una enfermedad psiquiátrica. Dado que el eje HPA es un elemento central para el procesamiento del estrés, podría resultar que localiza nuevos objetivos para el tratamiento de los trastornos inducidos por estrés en el eje. Los mecanismos que están siendo examinados incluyen el antagonismo de los receptores glucocorticoides, los receptores del factor de liberación de corticotropina 1 (CRF-1) y los receptores de vasopresina 1B.
El ESTRÉS
- Disminuye BDNF
- Produce ATROFIA Y APOPTOSIS neuronal en HIPOCAMPO y córtex PREFRONTAL
- Disminuye MONOAMINAS
- Produce ATROFIA Y APOPTOSIS neuronal en HIPOCAMPO y córtex PREFRONTAL
Estrés y entorno: ¿Cuánto estrés es demasiado estrés?
En muchos sentidos, el cuerpo está construido para gestionar el estrés, y de hecho una cierta cantidad de “carga de estrés” en huesos, músculos y cerebro es necesaria para el crecimiento y funcionamiento óptimo y puede incluso estar relacionado con el desarrollo de resistencia a futuros factores de estrés. Sin embargo, determinados tipos de estrés como el abuso infantil, bullying, o etc. pueden sensibilizar los circuitos cerebrales y hacerlos vulnerables más que resistentes a futuros factores de estrés.
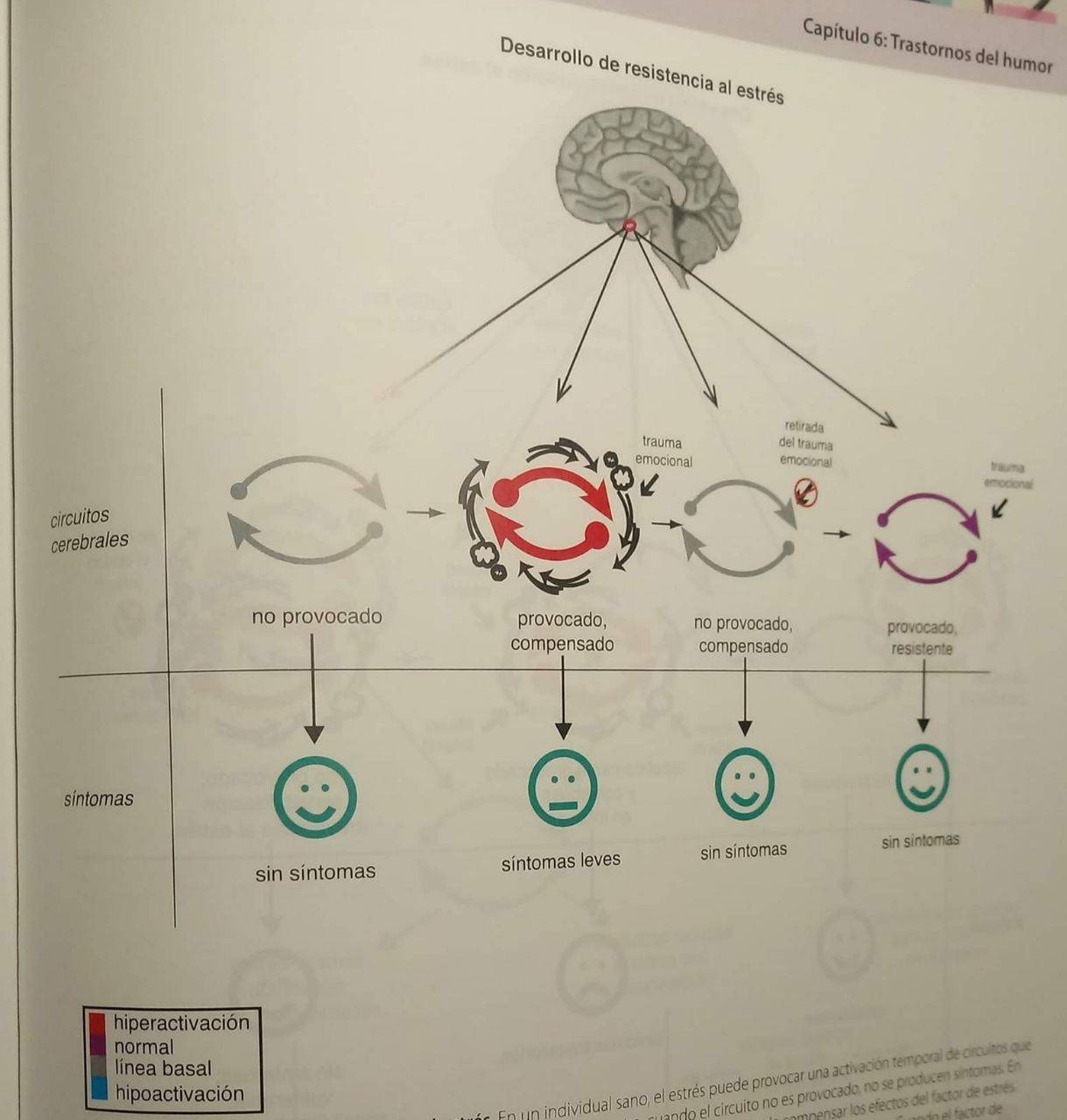
Desarrollo de resistencia al estrés. En un individual sano, el estrés puede provocar una activación temporal de circuitos que se resuelve cuando el factor de estrés es retirado. Como aquí se muestra, cuando el circuito no es provocado, no se producen síntomas. En presencia de un factor de estrés como trauma emocional, el circuito es provocado pero puede compensar los efectos del factor de estrés. Mediante su capacidad de procesamiento de carga de información del entorno, puede evitar el producir síntomas. Cuando el factor de estrés es retirado, el circuito vuelve a la línea basal de funcionamiento. Los Individuos expuestos a este tipo de estrés a corto plazo pueden incluso desarrollar resistencia al estrés, por la que la exposición a futuros factores de estrés provocará la activación del circuito, pero no dará lugar a síntomas.
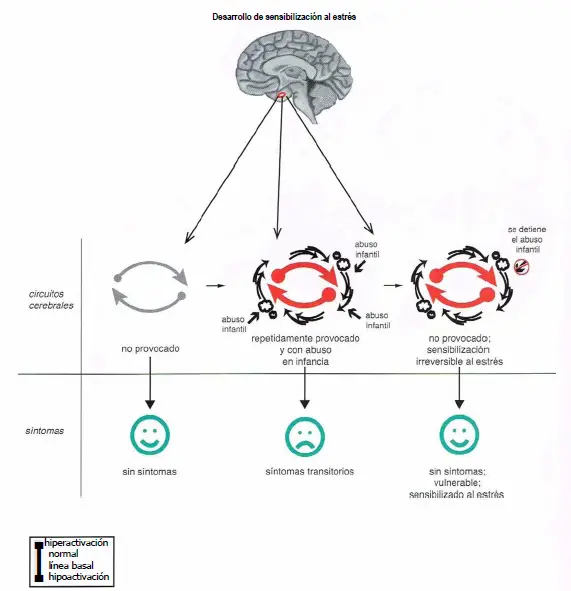
Desarrollo de sensibilización al estrés. La activación prolongada de circuitos debido a una exposición a factores de estrés puede dar lugar a un estado conocido como «sensibilización al estrés», en el que los circuitos no solo se vuelven sobreactivados sino que permanecen así incluso cuando se retira el factor de estrés. Así, un individuo con estrés grave en la infancia presentará síntomas transitorios durante la exposición al estrés, con resolución de los síntomas cuando el factor de estrés se retire, los circuitos permanecen sobreactivados en este modelo, pero el individuo no presenta síntomas porque estos circuitos todavía pueden compensar de alguna manera esta carga adicional. Sin embargo, el individuo con circuitos «sensibilizados al estrés» ahora es vulnerable a los efectos de futuros factores de estrés, de modo que el riesgo de desarrollar síntomas psiquiátricos resulta aumentado. La sensibilización al estrés puede, por tanto, constituir un estado «presintomático» para algunos síntomas psiquiátricos. Este estado podría ser detectable con escáneres funcionales del cerebro, pero no a partir de entrevistas psiquiátricas o de las quejas del paciente.
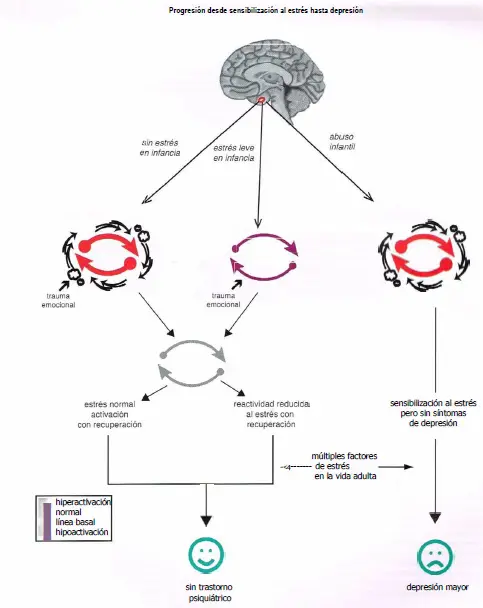
Progresión desde sensibilización al estrés hasta depresión. Puede ocurrir que el grado de estrés que uno experimenta durante la infancia afecte sobre el desarrollo de los circuitos y, por tanto, sobre cómo un determinado individuo responde al estrés en la vida adulta. La falta de estrés durante la infancia puede dar lugar a un circuito que presente activación «normal» durante el estrés y que no conlleve un riesgo aumentado de desarrollar un trastorno psiquiátrico. Es interesante constatar que el estrés leve durante la infancia puede en realidad causar que los circuitos exhiban una reactividad reducida al estrés en la vida adulta y aportar resistencia a los factores de estrés como adulto. Sin embargo, un estrés sobrepasado y/o crónico derivado de abuso infantil puede dar lugar a circuitos sensibilizados al estrés que podrían resultar activados incluso en ausencia de un factor de estrés. Los individuos con sensibilización al estrés podrían no presentar síntomas fenotípicos, pero podrían tener un mayor riesgo de desarrollar una enfermedad mental si son expuestos a futuros factores de estrés.
En teoría, los cambios epigenéticos causados por estrés ambiental crean alteraciones moleculares relativamente permanentes en los circuitos cerebrales en el momento del abuso del niño que no causan depresión per se, pero hacen los circuitos cerebrales vulnerables a una caída en depresión ante la exposición a futuros factores de estrés como adulto.
Estrés y vulnerabilidad genética: ¿nacido con miedo?
Existe un gran solapamiento entre los genes considerados de vulnerabilidad genética para la esquizofrenia y aquellos considerados de vulnerabilidad genética para el trastorno bipolar.
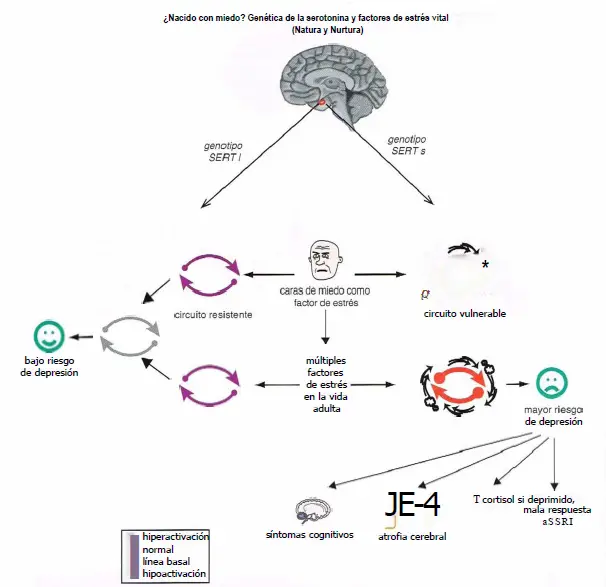
Genética de la serotonina y factores de estrés vital. La investigación genética ha mostrado que la bomba de recaptación de serotonina (SERT) con el que nacemos puede afectar al modo en que procesamos estímulos de temor y quizá también cómo respondemos al estrés. Específicamente, los individuos que son portadores de la variantes del gen del SERT parecen ser más vulnerables a los efectos de estrés o ansiedad, mientras aquellos que portan la variante / parecen ser más resistentes. Así, los portadores presentan un aumento de la actividad de la amígdala en respuesta a caras que dan miedo y también es más probable que puedan desarrollar un trastorno del humor o de ansiedad tras sufrir múltiples factores de estrés vital. El aumento del riesgo de depresión también puede estar relacionado con una mayor probabilidad de síntomas cognitivos, atrofia cerebral, aumento de cortisol y, si estén deprimidos, mala respuesta a los inhibidores selectivos de la recaptación de serotonina (SSRIs).
Quizá podamos nacer sin miedo, pero vulnerables o resistentes a desarrollar depresión mayor en respuesta a futuros factores de estrés como adultos, especialmente si son crónicos, múltiples, y graves.
MergedFile
Síntomas y circuitos en depresión
La hipótesis monoaminérgica de la depresión está siendo actualmente aplicada para determinar cómo el sistema de neurotransmisión monoaminérgico regula la eficiencia de la información procesada en una amplia variedad de circuitos neuronales que pueden ser responsables de mediar los distintos síntomas de la depresión.
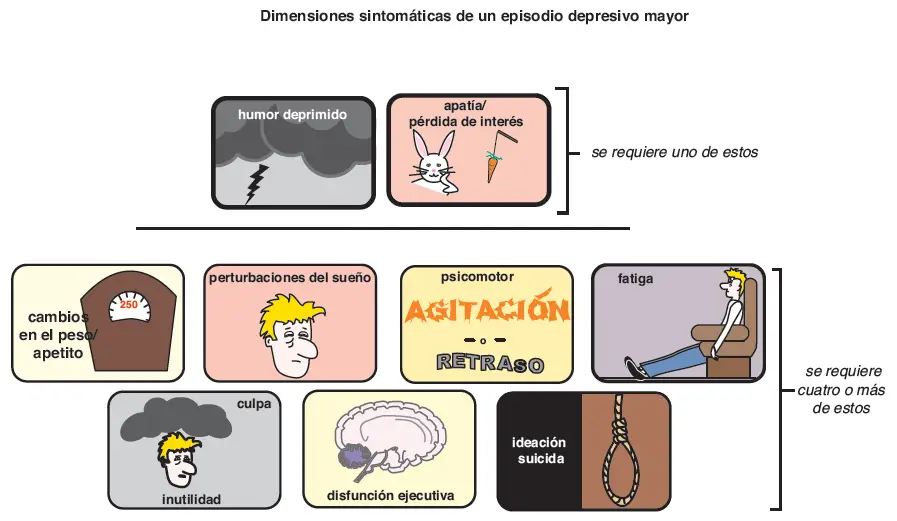
Síntomas de depresión. De acuerdo con el Manual Diagnóstico y Estadístico de los Trastornos Mentales, cuarta edición (DSM- V), un episodio depresivo mayor consiste en humor deprimido o pérdida de interés y al menos cuatro de los siguientes: cambios en el apetito/peso, insomnio o hipersomnia, agitación o retraso motor, fatiga, sentimientos de culpa o de inutilidad, disfunción ejecutiva e ideación suicida.
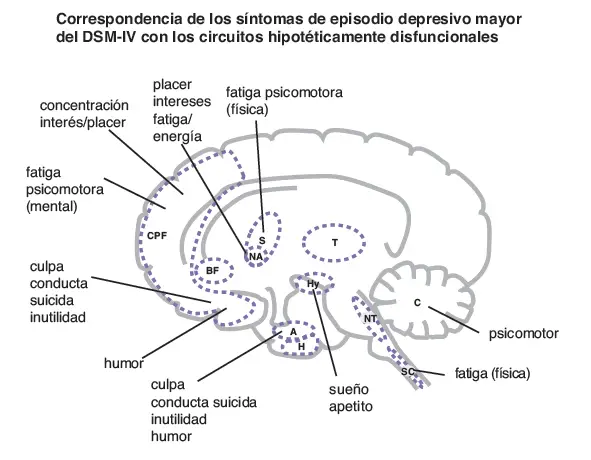
Correspondencia de los síntomas de depresión con los circuitos. Las alteraciones en la actividad neuronal y en la eficiencia del procesamiento de la información en cada una de las once áreas cerebrales mostradas aquí puede dar lugar a los síntomas de un episodio depresivo mayor. La funcionalidad en cada área cerebral está hipotéticamente asociada con una constelación diferente de síntomas. PFC, córtex prefrontal; PB, prosencéfalo basal: E, estriado; NA, nucleus accumbens; T, tálamo; Hy, hipotálamo; A, amígdala; H, hipocampo; NT, centros neurotransmisores del tronco cerebral; SC, médula espinal; C, cerebelo.
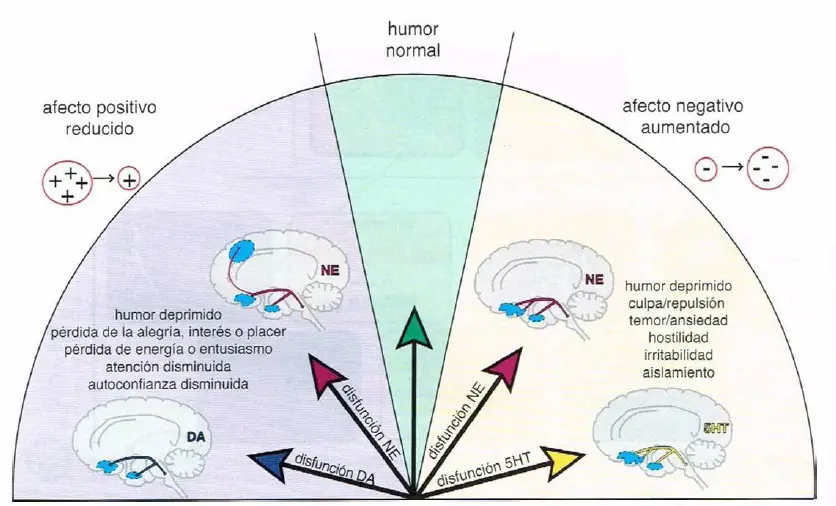
Afecto positivo y negativo. Los síntomas de depresión relacionados con el humor pueden ser caracterizados en términos de su expresión afectiva -es decir, si causan una reducción del afecto positivo o un aumento del afecto negativo. Los síntomas que conducen a una reducción del afecto positivo incluyen humor deprimido; pérdida de la alegría, interés o placer; pérdida de energía o entusiasmo; atención disminuida; y autoconfianza disminuida. La reducción del afecto positivo puede estar hipotéticamente relacionada con disfunción dopaminérgica, y también con una posible disfunción noradrenérgica. Los síntomas asociados con aumento del afecto negativo incluyen humor deprimido, culpa, repulsión, temor, ansiedad, hostilidad, irritabilidad y aislamiento. El aumento del afecto negativo puede estar hipotéticamente relacionado con la disfunción serotoninérgica y quizás con la disfunción noradrenérgica.
Síntomas y circuitos en depresión
Los pacientes con síntomas de ambos grupos pueden requerir tratamientos de triple
acción que potencien los tres neurotransmisores monoaminérgicos.
Disfunción DA y NE:
- Afecto positivo reducido:
- Humor deprimido.
- Pérdida de alegría, interés o placer.
- Pérdida de energía o entusiasmo.
- Atención disminuida.
- Autoconfianza disminuida.
Disfunción 5HT y NE:
- Afecto negativo aumentado:
- Humor deprimido.
- Culpa, repulsión.
- Temor, ansiedad.
- Hostilidad, irritabilidad.
- Aislamiento.
El refuerzo de la función serotoninérgica, y posiblemente también de la función noradrenérgica, puede mejorar el procesamiento de la información en los circuitos que teóricamente regulan este grupo de síntomas. Los pacientes con síntomas de ambos grupos pueden requerir tratamientos de triple acción que potencien los tres neurotransmisores monoaminérgicos.
Síntomas y circuitos en la manía
El mismo paradigma general de la regulación monoaminérgica de la eficiencia del procesamiento de la información en circuitos cerebrales específicos puede aplicarse a la manía y a la depresión, aunque frecuentemente en la dirección opuesta y en algunas áreas superpuestas, pero también en algunas áreas cerebrales diferentes a las de la depresión.
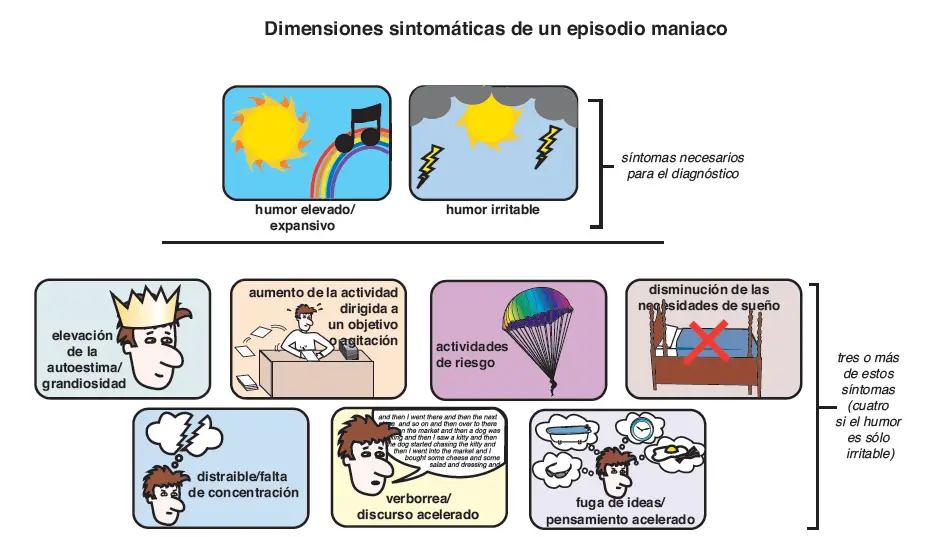
Síntomas de manía. De acuerdo con el Manual Diagnóstico y Estadístico de los Trastornos Mentales (DSM-IV), un episodio maniaco consiste en humor elevado/expansivo o irritable. Además, al menos tres de los siguientes deben estar presentes (cuatro si el humor es irritable): elevación de la autoestima/grandiosidad, aumento de la actividad dirigida a un objetivo o agitación, actividades de riesgo, disminución de las necesidades de sueño, distraibilidad, discurso acelerado y pensamiento acelerado.
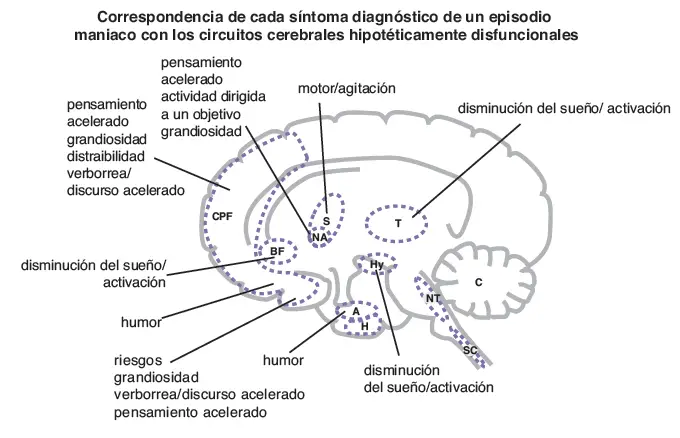
Correspondencia de los síntomas de manía con los circuitos. Las alteraciones en la neurotransmisión dentro de cada una de las once áreas cerebrales mostradas aquí puede estar hipotéticamente asociada a los distintos síntomas de un episodio maniaco. La funcionalidad en cada área cerebral puede asociarse con diferentes constelaciones de síntomas. PFC, córtex prefrontal; PB, prosencéfalo basal; E, estriado; NA, nucleus accumbens; T, tálamo; Hy, hipotálamo; A, amígdala; H, hipocampo; NT, centros neurotransmisores del tronco cerebral; SC, médula espinal; C, cerebelo.
Síntomas y circuitos en manía
Los tratamientos de la manía normalmente reducen o estabilizan la regulación trimonoaminérgica de los circuitos asociados con los síntomas.
- Córtex prefrontal: pensamiento acelerado, grandiosidad, distracción, verborrea, humor.
- Prosencéfalo basal: activación, disminución del sueño.
- Amígdala: humor.
- Hipotálamo: activación, disminución del sueño.
- Tálamo: activación, disminución del sueño.
- Estriado: motor, agitación.
- Núcleo Accumbens: pensamiento acelerado, grandiosidad, actividad dirigida a un objetivo.
Generalmente, el funcionamiento ineficiente en estos circuitos en la manía puede ser esencialmente lo opuesto a la disfunción planteada para la depresión, aunque la descripción más apropiada puede ser “desafinado” más que simplemente excesivo o deficiente, especialmente porque algunos pacientes pueden tener simultáneamente síntomas depresivos y maniacos. Sin embargo, los tratamientos de la manía normalmente reducen o estabilizan la regulación trimonoaminérgica de los circuitos asociados con los síntomas de la misma.
AUTOEVALUACIÓN
Si en temas anteriores se observa que en los exámenes se repite alguna pregunta, este tema más.
REFERENCIAS
- Stahl, S., & Muntner, N. (2016). Psicofarmacología esencial de Stahl : Bases neurocientíficas y aplicaciones prácticas (4ª ed.; Ed. especial para alumnos de la UNED. ed., Aula Médica Formación en Salud). Madrid: Aula Médica.
- PowerPoint Profesora Alicia Ferrer Vadell
- Apuntes Dany Blázquez
- YouTube